КОНСТАНТЫ ХИМИЧЕСКОГО РАВНОВЕСИЯ.
ЛЕКЦИЯ 7
Запишем условие химического равновесия для реакции (106):
 . (109)
. (109)
Выразим химические потенциалы реагирующих веществ через их парциальные давления:
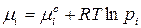 . (95)
. (95)
Подставим в (109) значения химических потенциалов, при этом перенесем все функции температуры вправо:
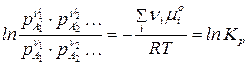 .
.
Выражение, стоящее справа есть постоянная величина при постоянной температуре, обозначим ее через 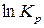 . Тогда получаем:
. Тогда получаем:
 , (110)
, (110)
где 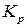 – константа химического равновесия – постоянная величина при постоянной температуре.
– константа химического равновесия – постоянная величина при постоянной температуре.
Уравнение (110) называют законом действующих масс: при равновесии отношение произведений парциальных давлений продуктов реакций, взятых в степенях, равных стехиометрическим коэффициентам, к аналогичному произведению для исходных веществ, есть величина постоянная при постоянной температуре.
Равновесие участвующих в химической реакции веществ может быть достигнуто различными способами:
Например: а) 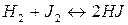
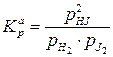 ;
;
б) 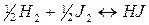
 .
.
Следовательно,  .
.
Таким образом, константа равновесия химической реакции при 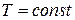 не зависит от состава равновесной смеси, но зависит от способа написания химической реакции.
не зависит от состава равновесной смеси, но зависит от способа написания химической реакции.
Для смеси идеальных газов закон действующих масс можно выразить через равновесные концентрации.
По уравнению Менделеева – Клапейрона связь между парциальным давлением и молярной концентрацией 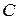 :
:  ,
, 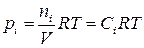 .
.
Подставим значение 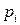 в закон действующих масс (110), получим:
в закон действующих масс (110), получим:
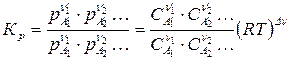 ,
,
где 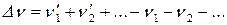 – изменение числа моль в ходе реакции.
– изменение числа моль в ходе реакции.
Обозначим
 . (111)
. (111)
где 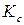 – константа химического равновесия, выраженная через молярные концентрации.
– константа химического равновесия, выраженная через молярные концентрации.
По уравнению Дальтона связь между 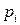 и мольной долей компонента выражается:
и мольной долей компонента выражается:
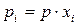 . (97).
. (97).
Тогда
 .
.
Обозначим
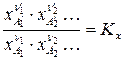 . (112)
. (112)
где 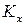 – константа химического равновесия, выраженная через мольные доли.
– константа химического равновесия, выраженная через мольные доли.
Таким образом, константа 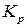 связана с
связана с 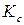 и
и 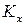 уравнениями:
уравнениями:
 ; (113)
; (113)
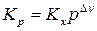 . (114)
. (114)
Для реакции, протекающей в реальном газовом растворе, химические потенциалы компонентов выражают через фугитивности реагирующих веществ:
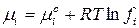 , (101)
, (101)
Тогда
 .
.
Если реакция протекает в реальном жидком растворе, то выражение для константы равновесия имеет вид:
 .
.
Если химическая реакция протекает с участием твердых веществ, то они не входят в закон действия масс, так как химический потенциал твердых веществ не изменяется в ходе протекания реакции.
В общем случае численные значения 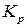 ,
, 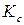 и
и 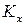 не совпадают. Совпадение наблюдается лишь для реакций, идущих без изменения числа моль.
не совпадают. Совпадение наблюдается лишь для реакций, идущих без изменения числа моль.
 2014-02-12
2014-02-12 879
879








