Пусть в идеальной газовой фазе при 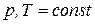 протекает химическая реакция:
протекает химическая реакция:
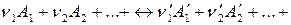 , (106)
, (106)
где 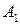 ,
, 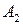 , … – исходные вещества:
, … – исходные вещества:
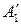 ,
,  ,… – продукты реакции;
,… – продукты реакции;
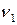 ,
, 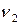 ,
, 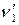 ,
, 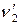 – стехиометрические коэффициенты.
– стехиометрические коэффициенты.
Условием химического равновесия является минимум энергии Гиббса: 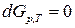 . Следовательно,
. Следовательно,
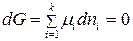 . (90)
. (90)
Вещества реагируют пропорционально стехиометрическим коэффициентам. Для характеристики протекания реакции введем понятие химической переменной 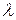 , определяющей степень продвижения реакции или ее развития:
, определяющей степень продвижения реакции или ее развития:
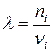 ,
,
где 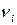 – стехиометрический коэффициент в уравнении реакции: для продуктов стехиометрические коэффициенты положительны, а для исходных веществ – отрицательны.
– стехиометрический коэффициент в уравнении реакции: для продуктов стехиометрические коэффициенты положительны, а для исходных веществ – отрицательны.
Физический смысл химической переменной: 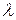 равна числу моль компонента, вступившего в реакцию, приходящемуся на единицу стехиометрического коэффициента.
равна числу моль компонента, вступившего в реакцию, приходящемуся на единицу стехиометрического коэффициента.
Тогда
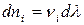 .
.
Уравнение (90), после выноса за знак суммы общего сомножителя 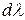 , перепишется:
, перепишется:
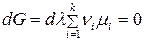 . (107)
. (107)
Произведение равно нулю, если хотя бы один из множителей равен нулю. Дифференциал химической переменной 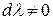 не может быть равен нулю по определению, следовательно
не может быть равен нулю по определению, следовательно
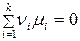 . (108)
. (108)
Полученное равенство представляет собой термодинамическое условие химического равновесия: при химическом равновесии алгебраическая сумма произведений химических потенциалов на стехиометрические коэффициенты равна нулю (произведения для продуктов реакции положительны, а для исходных веществ – отрицательны).
Пример: 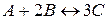 ;
;
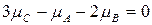 .
.
 2014-02-12
2014-02-12 963
963








