Первый закон термодинамики, его приложение
Первый закон термодинамики является количественной формулировкой всеобщего закона сохранения энергии применительно к процессам, связанным с превращениями теплоты и работы.
Закон сохранения энергии: энергия не возникает из ничего и не исчезает бесследно; она лишь превращается из одних видов в другие, причем, строго в эквивалентных количествах.
Первый закон термодинамики возник в эпоху создания тепловых двигателей. С появлением тепловых машин перед человечеством встала естественная задача создания экономически выгодных машин. Предпринимались многочисленные попытки создания вечного двигателя I рода − тепловой машины, производящей работу без затрат энергии. Первый закон термодинамики – это постулат; он не может быть доказан логическим путем или выведен из каких-либо более общих положений. Истинность его подтверждается тем, что ни одно из его следствий не находится в противоречии с опытом.
Существует несколько формулировок I закона, например:
– в любой изолированной системе запас энергии остается постоянным;
– невозможно создать вечный двигатель I рода;
 – теплота, подведенная к системе Q, расходуется на совершение системой работы A и на увеличение ее внутренней энергии D U:
– теплота, подведенная к системе Q, расходуется на совершение системой работы A и на увеличение ее внутренней энергии D U:
 (1)
(1)
Для бесконечно малого изменения состояния системы (в дифференциальной форме)
 . (2)
. (2)
Знак d в уравнении (2) отражает тот факт, что теплота и работа − функции процесса и их бесконечно малое изменение не является полным дифференциалом.
В уравнениях (1) и (2) используется термодинамическая система знаков: теплота положительна, если она передается системе; работа положительна, если она совершается системой.
В общем случае работа является суммой нескольких качественно различных видов работ (механической, электрической, магнитной, поверхностной и др.). В термодинамике принято все виды работы за исключением работы расширения (сжатия) p D V называть полезной работой 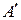 .
.
Тогда уравнения (1)-(2) примут вид:
Q = D U + p D V + A¢,
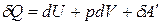 .
.
Если совершается только работа расширения (сжатия), т.е. A¢ = 0, то
Q = D U + p D V,
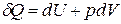 . (3)
. (3)
Практическое значение I закона термодинамики состоит в возможности расчета тепловых эффектов различных процессов и работы, совершаемой системой при их осуществлении.
Применим уравнение (3) к основным термодинамическим процессам.
1) Изохорный процесс (V = const, dV = 0). Так как работа расширения при этом равна 0, то, очевидно, что вся теплота, подведенная к системе, идет на увеличение внутренней энергии:
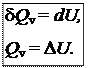
Таким образом, теплота изохорного процесса равна изменению внутренней энергии и, следовательно, является функцией состояния.
2) Изобарный процесс (p = const, dp = 0).
Из математики: любую константу можно внести под знак дифференциала, а сумма дифференциалов равна дифференциалу от суммы.
Уравнение (3) в этом случае запишется в виде
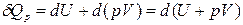 ,
,
где U + pV º H − функция состояния системы, называемая энтальпией.
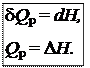
Таким образом, теплота изобарного процесса равна изменению энтальпии и является функцией состояния.
Работа расширения изобарного процесса
А = p D V = p (V 2 – V 1),
где V 1, V 2 – объем системы в исходном и конечном состояниях.
Если изобарный процесс протекает в идеальном газе, то в соответствии с уравнением Менделеева-Клапейрона для исходного 1 и конечного 2 состояний можно записать:
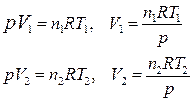 .
.
Тогда
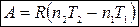 (4).
(4).
Для изобарно-изотермического процесса (р, Т = const)
Т 1 = Т 2 = Т
уравнение (4) запишется:
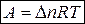 ,
,
где 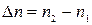 .
.
Связь между Q v и Q p определяется уравнением:
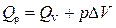 .
.
Для реакций, протекающих с участием только конденсированных фаз (твердых и жидких), объем системы практически не изменяется (D V = 0) и Q p» Q v. Для реакций, протекающих с участием веществ в газообразном состоянии, в том числе идеальных и реальных газов при невысоких давлениях, к которым применимо уравнение Менделеева-Клапейрона,
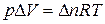 ,
,
т.е. при р, Т = const изменение объема вызвано уменьшением или увеличением числа моль газообразных! компонентов в системе:
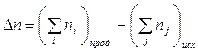 .
.
Следовательно,
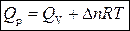 ,
,
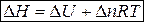 .
.
3. Изотермический процесс (Т = const)
Рассмотрим изотермический процесс, протекающий в идеальном газе. Согласно закону Гей-Люссака-Джоуля внутренняя энергия идеального газа зависит только от температуры и не зависит от давления и объема. Это значит, что при
Т = const Δ U = 0. Это означает, что при Т = const внутренняя энергия идеального газа не изменяется, т.е. U = const, а dU = 0.
Следовательно,
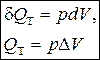 .
.
Таким образом, в изотермическом процессе работа (d A = pdV) совершается только за счет поглощаемой теплоты (d Q T).
Для идеального газа в соответствии с уравнением Менделеева Клапейрона
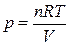 ,
,
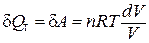 .
.
После интегрирования
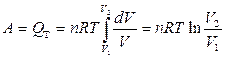 .
.
При Т = const
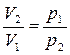 ,
,
тогда
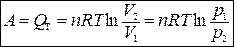 .
.
4) Адиабатический процесс осуществляется без теплообмена с окружающей средой (d Q = 0).
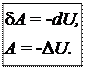 .
.
В адиабатическом процессе работа может совершаться только за счет убыли внутренней энергии.
Таблица – Приложение I закона к термодинамическим процессам
| Процесс | Уравнение I закона термодинамики | Уравнение для расчета работы расширения |
| Изохорный (V = const) | d Q v= dU, Q v= D U | p D V = 0 |
| Изобарный (p = const) | d Q p= dH, Q p= D H | 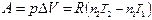 , при p, T = const , при p, T = const 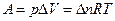 |
| Изотермический (Т = const) | Для идеального газа | |
| d Q T= pdV, Q T= p D V | 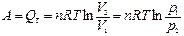 | |
| Адиабатический (Q = const) | d Q = 0 | A = p D V = -D U |
 2014-02-12
2014-02-12 1538
1538







