ТЕМА: ЗАГРЯЗНЕНИЕ ПРОДОВОЛЬСТВЕННОГО СЫРЬЯ ПРЕПАРАТАМИ, ПРИМЕНЯЕМЫМИ В ЖИВОТНОВОДСТВЕ
ЛЕКЦИЯ 8
Цель: Рассмотреть проблемы применения и контроля гормональных препаратов, а также контроль за остаточным содержанием антибиотиков и других ветеринарных препаратов.
Термин «гормон> впервые применил английский физиолог Э.Г. Старлинг в 1905 г. (от греч. hormao - побуждаю, возбуждаю).
Гормоны представляют собой химические вещества, имеющие определенное значение для морфологического развития организма, а также для биохимической и биофизической деятельности его органов. Это органические вещества, продуцируемые живыми клетками и переносимые гуморальным путем, способные воздействовать регулирующим образом на функционирование различных систем организма. Большинство гормонов выделяются в межклеточную жидкость (кровь, лимфа и т. д.) И таким образом достигают органа их воздействия; однако некоторые гормоны, такие как тканевые и нейрогормоны, выделяются, минуя кровяной поток, непосредственно в пределы ограниченной тканевой территории их действия.
Одним из определяющих признаков гормонов является их биологическая активность в очень малых концентрациях. По этому признаку гормоны относят к классу биологически активных веществ, к которым причисляются также ферменты и витамины. Однако гормоны не являются органическими катализаторами, как ферменты, хотя косвенно влияют на протекание катализируемых ферментами реакций обмена веществ. Гормоны отличаются от витаминов тем, что они попадают в организм не извне, а продуцируются внутри организма, причем строительный материал для биосинтеза гормонов может поступать в организм с пищей.
По действию на организм гормоны высших животных можно классифицировать следующим образом: 1) гормоны, стимулирующие обмен веществ (типа иодированных тиронинов); 2) гормоны, возбуждающие нервную систему например, ацетилхолин, пирокатехинамины); 3) гормоны воспроизводства (типа половых гормонов); 4) гормоны, регулирующие гормональное действие (тропины гипофиза).
По химической структуре гормоны можно разделить на производные феенола (адреналин, норадреналин, тироксин), белки (инсулин), гормоны передней доли гипофиза (хорионический гонадотропин, тиреоглобулин, секретин); пептиды (адренокортикотропный гормон (АКТГ), вазопрессин, окситоцин); стероидные гормоны (эстрогены, андрогены, прогестерон, кортикостероиды).
В последнее время гормоны и вещества с гормональной активностью, полученные синтетическим путем, нашли широкое применение в животноводстве, в частности, для улучшения усвояемости кормов, стимуляции плодовитости животных, многоплодия, регламентации сроков беременности, ускорения полового созревания и т. д. С развитием науки были созданы многие гормональные препараты, которые по анаболическому действию эффективнее природных гормонов в 100 и более раз. Высокая эффективность, а также дешевизна синтеза этих препаратов определили интенсивное внедрение их в практику животноводства (диэтилстильбэстрол, синэстрол, диенэстрол, гексэстрол и др.). Однако в отличие от природных аналогов многие синтетические гормональные препараты оказались более устойчивыми, они плохо метаболизируются и накапливаются в организме животных в больших количествах, мигрируя по пищевой цепочке в продукты питания.
Ограниченное использование искусственных стимуляторов роста допускается в США, Канаде, Австралии, Новой Зеландии, Аргентине и некоторых странах Южной Америки, Азии и Африки. Введение в небольших количествах некоторых гормональных препаратов вызывает у животных интенсивный прирост мышечной ткани. Речь идет о так называемых «гормональных технологиях» для выращивания птицы, крупного рогатого скота и свиней в ряде зарубежных стран. Так, инъекции диэтилстильбэстрола в количестве 10-100 мг/кг позволяют быстро получать привес скота на 5-25 %, что весьма привлекательно для производителей.
Остатки применяемых гормональных препаратов могут присутствовать в сыром мясе после убоя животных и попадать затем через мясные продукты в организм человека. Синтетические гормональные препараты стабильны при приготовлении пищи, способны вызывать нежелательный дисбаланс в обмене веществ и физиологических функциях организма человека. Применение гормональных препаратов и других биокатализаторов требует проведения тщательных гигиенических исследований по их токсикологии, накоплению в клетках и тканях организма.
В связи с опасностью избытка гормонов для человека законодательство устанавливает порядок контроля и ограничивает их использование. Например, в нашей стране не допускается применение в животноводстве стильбенов. Поэтому мясные продукты, продаваемые в розницу, не должны содержать диэтилстильбэстрол. Содержание эстрадиола и тестостерона не должно превышать 0,0005 и 0,015 мг/кг продукта соответственно. В зависимости от вида сырья максимальное содержание стимуляторов роста, стероидов и бета-блокаторов не должно превышать следующих значений (мг/кг):
зеранол 0,002-0,010
тренболон 0,002-0,010
карбадокс 0,005-0,030
дексаметазон 0,0005-0,0025
коразолол 0,005-0,025
В 1981 г. комитет ФАО/ВОЗ, рассмотрев использование гормонов и веществ с гормональной активностью в животноводстве, разделил употребляемые вещества на две категории:
1) гормоны, идентичные встречающимся у животных, мясо которых идет в пищу, и у людей, включая эфиры этих гормонов;
2) ксенобиотические соединения, такие как производные гормонов, соединения с гормональной активностью, природные вещества с гормональной активностью, не идентичные эндогенным гормонам человека, и производные этих соединений.
На заседании Комитета ФАО/ВОЗ было высказано соображение, что оценка приемлемости употребления ксенобиотических анаболических веществ при откорме животных, мясо которых идет в пищу, во многих отношениях подобна оценке пестицидов, поскольку для этого необходимы два элемента:
1) достаточно полные соответствующие токсикологические данные;
2) исчерпывающие данные о характере и уровне остатков при использовании указанных веществ в соответствии с передовой животноводческой практикой.
Что касается передовой животноводческой практики, то здесь необходимо получить данные об эффективности ксенобиотических анаболических веществ, количествах, используемых для достижения эффекта, и уровнях остатков, полученных при испытаниях на местах, а также информацию о методах анализа уровней остатков, которые могут быть использованы для контроля или с целью мониторинга. Токсикологические данные должны представляться с учетом потенциальной канцерогенной активности этих соединений и присутствия в продуктах животноводства остатков или метаболитов, которые могут вызвать эндокринологические или токсикологические последствия у потребителей.
Во многих странах, в том числе в странах Евросоюза и России, применение многих гормональных препаратов запрещено. Экономическая привлекательность применения химических стимуляторов требует жесткого контроля пищевой продукции на содержание остаточных гормонов. На основании действующих директив Европейского сообщества установлен и осуществляется систематический контроль за остаточным содержанием гормональных препаратов в мясе и мясных продуктах (мясо скота и птицы) по ряду веществ (табл.1).
Таблица 1
Нормируемые в странах ЕС уровни содержания гормональных препаратов
| Наименование | Объект контроля | Допустимый уровень содержания, мг/кг | Метод контроля |
| Тестостерон | Сыворотка крови | 0,5 | ГХ-МС, РИА, ВЭЖХ, ИФА |
| Эстрадиол 17 в | Сыворотка крови | 0,04 | ГХ-МС, РИА, ВЭЖХ, ИФА |
| Метилтестостерон | Сыворотка крови, Мясо | 2,0 | РИА,ИФА |
| Этинилэстрадиол | Мясо | ГХ-МС, ВЭЖХ, ИФА | |
| Тренболон | Мясо | ГХ-МС, РИА, ВЭЖХ, ИФА | |
| Диэтилстильбэстрол | Мясо, печень | ГХ-МС,РИА, ВЭЖХ, ИФА | |
| Зеранол | Мясо | ГХ-МС, ВЭЖХ, ИФА | |
| Кленбутерол | Сыворотка крови, мясо, печень | ГХ-МС, ВЭЖХ, ИФА | |
| Дексаметазон | Мясо, печень, сыворотка крови | 0,5 2,0 | ГХ-МС, ВЭЖХ, ИФА |
| 19-Нортестостерон | Мясо | 1,0 | РИА, ИФА |
| Гестагены | Жир | РИА, ВЭЖХ, ИФА | |
| Тиреостатики | сыворотка крови | Не более 100 | ГХ-МС, ТСХ, ВЭЖХ, |
Прuмечанuе. ГХ-МС - газовая хроматография с масс-селективным детектированием; РИА - радиоиммунологический анализ; ВЭЖХ - высокоэффективная жидкостная хроматография; ИФА - иммуноферментный анализ; ТСХ - тонкослойная хроматография.
В странах Европейского сообщества потребители избегают покупать мясо и мясные продукты, полученные с использованием «гормональных» технологий и содержащие остатки гормональных препаратов даже в безопасных для здоровья концентрациях. Борьба за европейский рынок вынуждает многие животноводческие предприятия отказываться от использования гормонов при выращивании скота.
К сожалению, в настоящее время в России предусмотрен только рекомендательный, а не обязательный порядок контроля гормональных препаратов. В частности, согласно СанПиН 2.3.2.1078-01 в продуктах животного происхождения контролируются остаточные количества стимуляторов роста животных, в том числе гормональных препаратов. Однако этот контроль основывается на информации, предоставляемой изготовителем (поставщиком) продукции, об использованных при ее изготовлении и хранении стимуляторах роста животных и лекарственных препаратов. Таким образом, если недобросовестный поставщик скроет информацию о фактическом выращивании мяса по «гормональным» технологиям, возникнет опасность проникновения на российский рынок продукции содержащей гормональные препараты, так как в этом случае определение остаточных количеств гормональных препаратов необязательно.
Контроль за остаточным содержанием антибиотиков и других, ветеринарных препаратов
Развитие сельскохозяйственного производства предусматривает использование в ветеринарии некоторых антимикробных препаратов для профилактики и лечения скота и птицы. Однако в силу их недостаточной эффективности в ряде случаев производители несанкционированно применяют антибиотические вещества, используемые для лечения человека (производные пенициллина, тетрациклина и левомицетина).
Применение таких препаратов может привести к последующему развитию устойчивой к данным веществам микрофлоры у человека, употребляющего в пищу продукты, содержащие антибиотики. У человека развивается дисбактериоз, и при назначении ему лечения антибиотиками велика опасность неэффективного лечения.
Возможность поступления таких мясных продуктов при импортировании, а также развитие собственного интенсивного животноводства и птицеводства делают проблему контроля весьма актуальной.
Хлорамфеникол (левомицетин) - синтетический антибиотик широкого спектра действия, применение которого запрещено к использованию в животноводстве. Относительная дешевизна препарата и высокая антибактериальная эффективность приводят к его несанкционированному использованию в достаточно широких масштабах, поэтому в мясе, печени, почках, молоке, твороге, сметане, сыре, яйце и других продуктах довольно часто обнаруживаются остаточные количества левомицетина в концентрациях от 0,02-0,50 ед./г образца (1 ед. активности соответствует 1 мкг чистого вещества).
Тетрациклин является высокоэффективным антибиотиком широкого спектра действия и используется в медицине для лечения различных заболеваний, а также в ветеринарии из-за высокой противомикробной эффективности (хлортетрациклин, окситетрациклин), что является небезопасным с точки зрения развития устойчивости микрофлоры к данному антибиотику у человека, потребляющего в пищу продукцию, загрязненную тетрациклинами. ПДК остаточного содержания антибиотиков тетрациклиновой группы в мясных, молочных и других пищевых продуктах, составляет 0,01 ед./г (у высокочистого тетрациклина 1 ед. соответствует 1 мкг).
В действующих на территории Российской Федерации требованиях к безопасности мясных продуктов остаточное содержание антибиотиков не допускается и нормируется на уровне долей единицы антибиотической активности (мкг) в одном грамме образца (табл. 2).
Таблица 2
Допустимые уровни содержания антибиотиков в продуктах питания, ед./г, не более
| Группа продуктов | Тетрациклиновая группа | Гризин | Бацитрацин | Стрептомицин | Пенициллин | Низин |
| Мясо и птица свежие и охлажденные. Субпродукты и продукты их переработки | 0,01 | 0,05 | 0,02 | - | - | - |
| Яйца и яйцепродукты | 0,01 | 0,5 | ||||
| Молоко и кисломолочные изделия, в том числе сухие молочные изделия; сыры и творожные изделия; масло из коровьего молока; казеин | 0,01 | - | - | 0,5 | 0,01 | - |
| Молоко сгущенное | 0,01 | - | - | 0,5 | 0,01 |
В настоящее время для аналитического определения остатков антибиотических препаратов используются микробиологические методы, основанные на регистрации роста тест-культур микроорганизмов в присутствии стандартных количеств антибиотиков и анализируемых экстрактов; высокоэффективная жидкостная хроматография; жидкостная хроматография с масс-спектрометрическим детектированием (ЖХМС); тонкослойная хроматография (ТСХ), позволяющая регистрировать появление индивидуального пятна анализируемого вещества; флуоресцентный анализ, основанный на образовании флуоресцирующего комплекса антибиотика со специальным органическим хромофором. Метод газовой хроматографии не используют из-за сложности перевода антибиотиков в летучее состояние.
Следует отметить, что традиционное применение хроматографических и спектральных методов для анализа остаточных количеств ветеринарных препаратов позволяет решать задачу аналитического контроля качества, однако имеется ряд проблем. Во-первых, хроматографическая идентификация предусматривает анализ содержания конкретного вещества по времени удержания хроматографического пика. Известно значительное количество причин, по которым времена удержания могут варьироваться и даже совпадать для некоторых веществ. В случае очень низких, концентраций веществ эта особенность часто является неразрешимой проблемой даже при использовании внутренних стандартов определяемых веществ. Ведущие производители хроматографического оборудования предлагают для надежной двойной идентификации вещества в установленном пике использовать, например, запись УФ-спектра или масс-спектра вещества с последующим сравнением со стандартной базой компьютерных данных. Такой подход к определению остаточного содержания опасных примесей в продовольственном сырье является достаточно надежным, но требует очень дорогостоящего аналитического оборудования и не может быть рекомендован для серийного анализа.
С учетом требований, предъявляемых к экспресс-методам мониторинга продовольствия (чувствительность, селективность метода, скорость получения результатов, стоимость выполнения анализов), наиболее предпочтительным является метод иммуноферментного анализа, в частности его разновидность - метод ELISA, удовлетворяющий всем требованиям, предъявляемым к методам рутинного контроля.
Основные принципы иммуноферментного анализа (ИФА) были предсказаны немецким ученым Полем Эрлихом на рубеже XIX-XX вв. Размышляя о механизме функционирования защитных систем живого организма, он сформулировал идею «антител», вырабатываемых организмом при проникновении в его ткани чужеродных объектов, названных «антигенами». Конкретный тип чужого объекта и способ защитной реакции на вторжение могут быть установлены организмом в результате сверхспецифичного взаимодействия антител и антигенов, точно подходящих друг к другу, как ключ к замку. Впоследствии фундаментальные идеи, выдвинутые Эрлихом, были положены в основу радиоиммунного метода анализа, за разработку которого профессор физики и ядерной медицины Розалин Ялоу в 1977 г. получила Нобелевскую премию. К настоящему времени радиоиммунный метод анализа, предусматривающий использование радиоактивных изотопов и применение достаточно сложного оборудования, практически вытеснен значительно более простым и безопасным методом ИФА.
Рассмотрим кратко упрощенную схему выполнения ИФА. Для анализа химических соединений в пищевых и биологических объектах в основном используется вариант «конкурирующего» иммуноферментного анализа, поэтому далее речь идет только об этом варианте ИФА, который называют также методом ELISA. Готовые наборы для ИФА в комплектной поставке производителя обычно включают все необходимые для выполнения анализа материалы, буферные и стандартные растворы. Антитела к тому или иному химическому соединению (антигену), полученные из сыворотки крови живых организмов, адсорбированы на твердую поверхность планшета, обычно на 96 лунок (рис. 1 а).
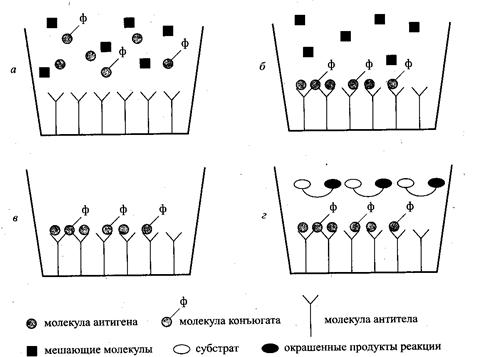 |
Рис.1 Схема выполнения иммуноферментного анализа (ИФА): а - начало процесса иммуносорбции; б - завершение процесса иммуносорбции; в - отмывка планшета; г - развитие цепной реакции
При контакте активированной поверхности носителя с раствором, содержащим антигены (например, левомицетин), часть антител специфично взаимодействует с молекулами контролируемого соединения, т. е. дезактивируется. В конкурирующем варианте ИФА контролируемый раствор смешивают непосредственно в лунке планшета с раствором так называемого конъюгата, представляющего собой молекулы антигена, химически связанные (меченые) с молекулами фермента. В течение некоторого периода инкубации планшета (от 30 мин до 2 ч) при определенной температуре антитела на поверхности носителя дезактивируются в результате иммуносорбции как меченых, так и немеченых антигенов (рис. 1 в).
После процедуры отмывки планшета, следующей за инкубацией, на поверхности носителя распределяются только сорбированные антигены, причем соотношение меченых и немеченых антигенов зависит от исходной концентрации антигенов в контролируемом растворе (рис. 1, в).
На стадии проявки в лунки планшета добавляют раствор так называемого субстрата. Фрагмент молекулы фермента, адсорбированной из раствора коньюгата вместе с меченым антигеном на поверхности лунки, катализирует химическую реакцию превращения субстрата в окрашенное соединение (рис. 1, г)
По окончании определенного времени развития данной цветной реакции в лунки планшета добавляют фиксирующий реагент и измеряют оптическую плотность содержимого каждой лунки. Поскольку одновременно с анализируемым раствором в некоторые лунки одного и того же планшета дозируются стандартные растворы, после измерения оптической плотности в лунках легко построить калибровочную кривую, по которой вручную или автоматически можно вычислить концентрацию контролируемого соединения в анализируемой пробе.
Таблица 3.
Минимальный уровень содержания антибиотиков в мясных продуктах, определяемый различными методами
| Метод | Определяемое вещество | Предел обнаружения | ПДК, не более | Время анализа, ч |
| ТСХ | Тетрациклин | 0,1 мкг/г | 0,01 ед./г | |
| Флуориметрия | -»- | 1 мкг/г | 0,01 ед./г | |
| ELISA | -»- | 6 пг/г | 0,01 ед./г | |
| ELISA | Левомицетин | 1 нг/г (мкг/кг) | 0,01 ед./г |
Применяемые аналитические методы определения содержания антибиотиков различаются по минимально определяемому уровню вещества в зависимости от свойств самого антибиотика (табл. 3). для аналитического определения сложных химических токсикантов пищевых продуктов используют методы, различающиеся по сложности и чувствительности. Наиболее удачное сочетание чувствительности, скорости и стоимости отличает иммуноферментный анализ, позволяющий достаточно быстро проводить скрининг пищевой продукции по максимальному числу показателей. Стандартный хроматографический анализ методом тонкослойной, газожидкостной и жидкостной хроматографии уступает методу ELISA по простоте и минимально определяемому уровню анализируемого вещества. Метод ИФА позволяет определять содержание вредных примесей на уровне до 0,1 нг/мл.
Наиболее оправдано применение метода ИФА для определения сложных органических токсикантов, в частности гормонов и антибиотиков.
 2014-02-12
2014-02-12 6049
6049








