При использовании таблиц термодинамических свойств индивидуальных веществ возможно применение следующих трех способов расчета К0:
I способ. Определение константы равновесия К0 по выражению:
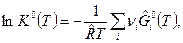 (1)
(1)
где 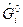 свободная энергия Гиббса i -го вещества в стандартном состоянии, которая вычисляется по формуле
свободная энергия Гиббса i -го вещества в стандартном состоянии, которая вычисляется по формуле 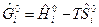 ;
; 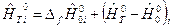 - полная энтальпия i -го вещества. Величины
- полная энтальпия i -го вещества. Величины 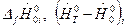 и энтропия
и энтропия 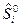 находятся с использованием таблиц справочной литературы.
находятся с использованием таблиц справочной литературы.
II способ. Определение константы равновесия К 0 с помощью приведенной энергии Гиббса 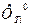 :
: 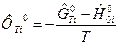 .
.
Тогда 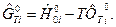
После подстановки 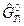 в (1), получим
в (1), получим
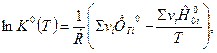 (2)
(2)
где величины 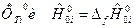 определяются из таблиц справочной литературы.
определяются из таблиц справочной литературы.
Ш способ. Определение константы равновесия К0 химической реакции типа 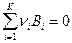 через константы равновесия химических реакций распада реагентов на газообразные атомы
через константы равновесия химических реакций распада реагентов на газообразные атомы 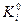 .
.
Уравнение химической реакции разложения i -го вещества Вi на газообразные атомы имеет вид: 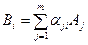 , где
, где 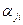 - число атомов j –го вида в i -м веществе; Aj - символ j –го атома.
- число атомов j –го вида в i -м веществе; Aj - символ j –го атома.
Для i -го вещества 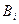 константа равновесия ХР распада вещества на газообразные атомы определяется выражением:
константа равновесия ХР распада вещества на газообразные атомы определяется выражением:
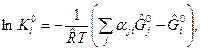 (3)
(3)
где 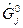 - молярная свободная энергия Гиббса в стандартном состоянии для
- молярная свободная энергия Гиббса в стандартном состоянии для
j –го газообразного атома; 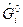 - молярная свободная энергия Гиббса для
- молярная свободная энергия Гиббса для
i – го вещества в любом агрегатном состоянии.
Из (3) следует
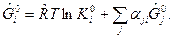 (4)
(4)
Подставляя 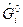 по формуле (4) в (1) получим:
по формуле (4) в (1) получим:
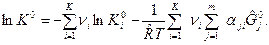 (5)
(5)
Второе слагаемое в правой части выражения (5) равно нулю, поскольку числа атомов j –го вида в исходных веществах и в продуктах реакции равны:
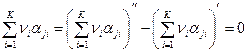 .
.
Тогда имеем:
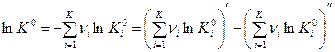 , (6)
, (6)
где К0 – константа равновесия ХР типа 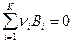 ;
; 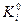 - константа равновесия химической реакции распада i - го вещества на газообразные атомы. Константы
- константа равновесия химической реакции распада i - го вещества на газообразные атомы. Константы 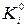 для каждого индивидуального вещества при соответствующей температуре приводятся в справочниках в виде десятичных логарифмов (lgK
для каждого индивидуального вещества при соответствующей температуре приводятся в справочниках в виде десятичных логарифмов (lgK 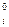 ). Тогда
). Тогда
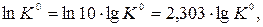 (7)
(7)
где 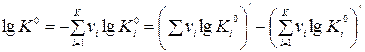 .
.
Из рассмотренных трех способов расчета константы равновесия химической реакции второй способ удобен при расчетах с помощью ЭВМ, поскольку легко рассчитать приведенную энергию Гиббса 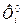 для каждого индивидуального вещества, используя коэффициенты аппроксимации, представленные в справочнике, третий способ удобен при ручном счете с использованием таблиц из справочника термодинамических свойств индивидуальных веществ.
для каждого индивидуального вещества, используя коэффициенты аппроксимации, представленные в справочнике, третий способ удобен при ручном счете с использованием таблиц из справочника термодинамических свойств индивидуальных веществ.
 2015-01-21
2015-01-21 1405
1405