По определению
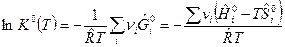 . (1)
. (1)
Возьмем производную от 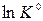 по температуре при p =const.
по температуре при p =const.
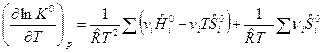 (2)
(2)
После преобразований (2) имеем:
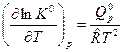 ,
, 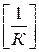 (3)
(3)
где 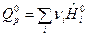 - изобарный тепловой эффект химической реакции.
- изобарный тепловой эффект химической реакции.
С учетом того, что 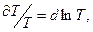 из (3) имеем в безразмерном виде уравнение изобары ХР:
из (3) имеем в безразмерном виде уравнение изобары ХР:
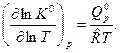 (4)
(4)
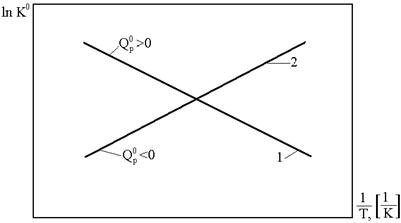
Уравнение изобары ХР устанавливает для идеального газа связь между константой равновесия, температурой и тепловым эффектом химической реакции при условии, что Т, р =const. Из него видно, что с ростом температуры константа равновесия увеличивается в эндотермических ХР 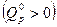 и уменьшается в экзотермических ХР
и уменьшается в экзотермических ХР 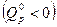 . При росте температуры эндотермические химические реакции сдвигаются в сторону продуктов ХР, (вправо), а экзотермические ХР (реакции горения) – в сторону исходных веществ (влево), как это видно из приведенного рисунка.
. При росте температуры эндотермические химические реакции сдвигаются в сторону продуктов ХР, (вправо), а экзотермические ХР (реакции горения) – в сторону исходных веществ (влево), как это видно из приведенного рисунка.
Для увеличения полноты реакции эндотермические ХР надо вести при больших температурах, а экзотермические ХР при низких температурах. В эндотермических ХР теплота подводится 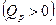 , а в экзотермических ХР - отводится
, а в экзотермических ХР - отводится 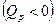 для выполнения условия сопряжения ТС с окружающей средой: p =const, T =const (правило знаков – обычное, принятое в термодинамике).
для выполнения условия сопряжения ТС с окружающей средой: p =const, T =const (правило знаков – обычное, принятое в термодинамике).
Получим аппроксимацию константы равновесия по температуре.
Запишем уравнение изобары ХР (3) в виде 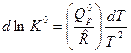 и возьмем от этого выражения интеграл при
и возьмем от этого выражения интеграл при 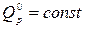 . Тогда получим:
. Тогда получим:
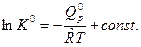 (5)
(5)
Введем обозначения: 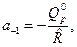
 Тогда
Тогда
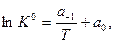 (6)
(6)
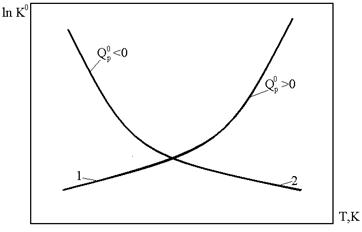
т.е. зависимость 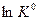 от обратной температуры
от обратной температуры 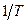 - линейная и ее наклон определяется величиной изобарного теплового эффекта ХР
- линейная и ее наклон определяется величиной изобарного теплового эффекта ХР 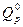 , как показано на следующем рисунке.
, как показано на следующем рисунке.
Так как К0(Т) зависит только от температуры, то производная по давлению 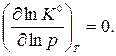
Соотношение (6) используется при аппроксимации констант равновесия К0 по температуре при расчетах и для экспериментального определения изобарного теплового эффекта химической реакции.
При экспериментальном определении теплового эффекта ХР Qp при различных температурах измеряют состав реагирующей смеси в состоянии равновесия и по нему рассчитывают парциальные давления pi. Затем по формуле 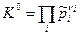 вычисляют
вычисляют 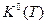 и
и 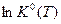 и строят график зависимости ln K 0= f (1/ Т).
и строят график зависимости ln K 0= f (1/ Т).
Находят тангенс угла наклона этой линейной зависимости
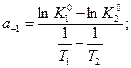
Определяют тепловой эффект химической реакции 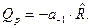
10.7. Производные констант равновесия Кх и Кс по температуре и давлению
Для газообразных ТС константа равновесия ХР, выраженная через молярные доли, - Кх равна: 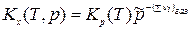 или
или
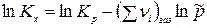 (1)
(1)
где 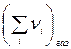 сумма стехиометрических коэффициентов газообразных реагентов ХР. Тогда производная по температуре от
сумма стехиометрических коэффициентов газообразных реагентов ХР. Тогда производная по температуре от 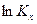 будет равна:
будет равна:
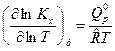 , (2)
, (2)
и производная по давлению:
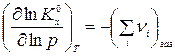 . (3)
. (3)
Константа равновесия, выраженная через молярные концентрации, Кс равна:
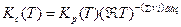
или
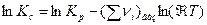 (4)
(4)
Тогда производные по температуре и давлению будут равны:
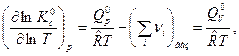 (5)
(5)
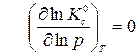 . (6)
. (6)
где 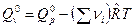 .
.
Уравнение (5) называется уравнением изохоры химической реакции при условии сопряжения термодинамической системы с окружающей средой при Т,V= const.
 2015-01-21
2015-01-21 2255
2255
