Пар – это газ над поверхностью жидкости, а испарение – это переход из жидкой фазы в газообразную (паровую). Кипение – это превращение жидкости в пар по всему ее объему.
Конденсация – это переход из паровой фазы в жидкую. Сублимация – переход из твердой фазы в газообразную. Десублимация – переход из газовой фазы в твердую.
Равномерная смесь мельчайших частиц жидкости и сухого насыщенного пара образует влажный насыщенный пар. При переходе всей жидкости в пар образуется сухой насыщенный пар. Насыщенный пар – это пар, находящийся в равновесии с жидкостью. Ненасыщенный пар – это пар, не находящийся в равновесии с жидкостью
Перегретым паром называется пар, температура которого выше температуры сухого насыщенного пара при данном давлении.
Степенью сухости: 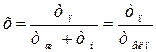 , или
, или 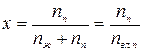 , называется массовая или молярная доля сухого насыщенного пара в смеси пара (индекс «п») с жидкостью (индекс «ж»). Для горячей воды при температуре насыщения (кипения) – ts степень сухости х =0. Для сухого насыщенного пара степень сухости х =1. Величина: у =1 -х, называется степенью влажности пара.
, называется массовая или молярная доля сухого насыщенного пара в смеси пара (индекс «п») с жидкостью (индекс «ж»). Для горячей воды при температуре насыщения (кипения) – ts степень сухости х =0. Для сухого насыщенного пара степень сухости х =1. Величина: у =1 -х, называется степенью влажности пара.
15.2. Фазовая диаграмма р-Т для однокомпонентной равновесной термодинамической системы
Эта диаграмма имеем вид, представленный на рисунке:
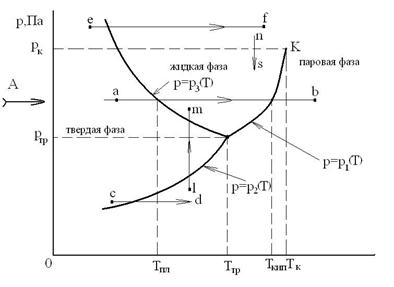
Равновесное существование 3-х фаз возможно только при определенных давлении ртр и температуре Ттр. Это состояние ТС называется тройной точкой, и что число степеней ее свободы равно нулю. Для воды значения: Ттр =273,15К и ртр =1 физич. атм.
Для двухфазной ТС существует однозначная зависимость р=р (Т), т.е. ТС обладает одной степенью свободы.
В однофазной ТС независимо могут изменяться два термодинамических параметра: давление р и температура Т (ТС обладает двумя степенями свободы).
На фазовой р-Т диаграмме линия р=р 1(Т) является кривой парообразования (испарения), на которой сосуществуют, т.е. находятся в равновесии, жидкая и паровая фазы.
Линия– р=р 2(Т) - это кривая сублимации, на которой находятся в равновесии твердая и паровая фазы. При этом подводятся энергия, равная теплоте сублимации.
Линия р=р 3(Т) - кривая плавления, на которой находятся в равновесии твердая и жидкая фазы.
Кривая парообразования р=р 1(Т) оканчивается для каждого вещества в точке К при определенных критических значениях давления рк и температуры Тк.
При критическом состоянии вещества пропадает различие между свойствами жидкости и пара. Для воды рк =221,3 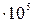 Па, Тк =647,3К (374,20С) и vк =0,0032м3/кг.
Па, Тк =647,3К (374,20С) и vк =0,0032м3/кг.
Кривые р1(Т), р2(Т) и р3(Т) разграничивают плоскость диаграммы р-Т на области, соответствующие паровой, жидкой и твердой фазам. Рассмотрим характерные процессы, представленные на р-Т диаграмме:
- «a-b» – изменение агрегатного состояния вещества: плавление при Тпл и парообразование при Тs=Ткип.
При этом свойства вещества изменяются скачком:
 и т.д.;
и т.д.;
- «c-d» - сублимация, т.е. переход из твердого состояния в пар;
- «e-f» - переход из твердого состояния в пар;
- «l-m» - переход из газообразного состояния в твердое, а затем в жидкое состояние;
- «n-s» - непрерывный (гомогенный) переход пара в жидкость.
Вид сбоку на пространственную фазовую диаграмму р-Т – v по стрелке «А» дает нам паровую диаграмму «р-v».
15.3. Паровая диаграмма p-v. Расчет количества теплоты, затраченной на процесс парообразования
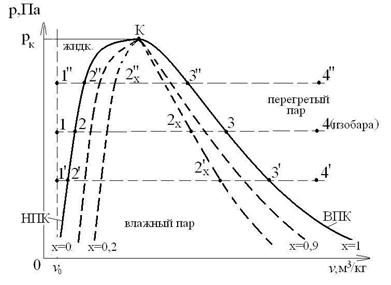
НПК – нижняя (левая) пограничная кривая (х =0) отражает состояние горячей воды при температуре насыщения t=ts=tкип.
ВПК – верхняя (правая) пограничная кривая (х =1) отражает состояние сухого насыщенного пара. Равновесие системы: «жидкость-пар», - динамическое равновесие. При рассмотрении процессов с паром используются следующие стандартные обозначения параметров, представленные в виде таблицы:
| № п/п | Состояние | Обозначения параметров | Точка на диаграмме |
| Горячая вода при t=ts(х=0) НПК | 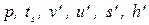 | т.2 | |
| Сухой насыщенный пар (х=1), ВПК | 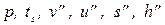 | т.3 | |
| Влажный пар при степени сухости «х» | 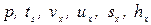 | т.2х | |
| Перегретый пар | 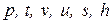 | т.4 |
Образование водяного пара проходит 3 стадии:
1. Подогрев жидкости от 00С до температуры кипения (насыщения) ts (процесс 1-2).
2. Парообразование при ts =const (ts = 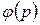 ).
).
3. Перегрев пара от ts до tпер.
Рассмотрим процесс «1-2» - нагрев жидкости. В т.1 температура холодной воды t 0=00С при давлении р. При подводе теплоты q по изобаре (p =const) вода нагревается от 00С до ts:
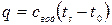 , Дж/кг. Так как t 0=00C q=cводts.
, Дж/кг. Так как t 0=00C q=cводts.
Теплоемкость воды в зависимости от температуры будем определять по формуле Дитеричи: Свод =4,2868(0,99827-0,00010368 t +0.0000020736 t 2), кДж/кгК. q = u 2- u 1, т.е. теплота q полностью идет на увеличение внутренней энергии жидкости, поскольку для жидкости v =const.
В изобарно-изотермическом процессе парообразование «2-3» (ps =const, Ts =const) подводится теплота парообразования: 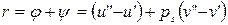 , Дж/кг.
, Дж/кг.
Удельная теплота парообразования «r» - это количество теплоты, которое необходимо затратить при данном давлении для перевода 1 кг кипящей жидкости в сухой насыщенный пар.
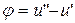 - это внутренняя теплота испарения, которая идет на преодоление сил внутреннего сцепления между молекулами (на работу дисгрегации), где
- это внутренняя теплота испарения, которая идет на преодоление сил внутреннего сцепления между молекулами (на работу дисгрегации), где 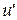 и
и 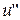 - внутренняя энергия при х =0 и х =1 соответственно.
- внутренняя энергия при х =0 и х =1 соответственно.
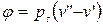 - это внешняя теплота испарения, которая идет на работу расширения пара (на вытеснение окружающей среды), где
- это внешняя теплота испарения, которая идет на работу расширения пара (на вытеснение окружающей среды), где 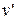 и
и 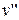 - удельный объем ТС при х =0 и х =1 соответственно.
- удельный объем ТС при х =0 и х =1 соответственно.
С ростом давления теплота парообразования «r» уменьшается и при давлении р=рк r =0.
В процессе «3-4» теплота qпер идет на перегрев пара от температуры ts до tпер при p =const:
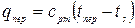 , Дж/кг,
, Дж/кг,
где cpm = f (T,p) – среднеинтегральная удельная теплоемкость перегретого пара в интервале температур от ts до tпер. Температура перегретого пара tпер не зависит от давления.
Полная теплота образования сухого насыщенного пара равна 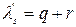 .
.
Пар высокого давления требует меньше теплоты для своего образования, т.е. является более экономичным при р >40.105Па. Полная теплота образования перегретого пара равна:
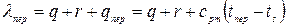 , Дж/кг.
, Дж/кг.
Полная теплота образования влажного пара со степенью сухости х:
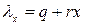 .
.
Рассмотрим изменение внутренней энергии пара при р =const для тех же процессов:
Процесс 1-2: 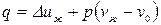 . Так как
. Так как 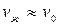 , то работой расширения можно пренебречь. Тогда
, то работой расширения можно пренебречь. Тогда 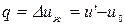 .
.
При t0=00C условно принимается, что 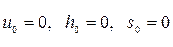 . Тогда
. Тогда
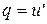 . (1)
. (1)
Теплота, подводимая в процессе 1-2 идет на увеличение внутренней энергии жидкости.
В процессе 2-3 внутренняя теплота испарения 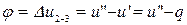 . Тогда
. Тогда
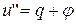 . (2)
. (2)
В процессе 2-2 х 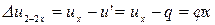 .
.
Тогда:
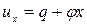 . (3)
. (3)
В процессе 3-4 в соответствии с 1-ым законом термодинамики имеем:
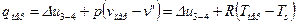 ,
,
где приближенно принимается, что  и
и  . Тогда:
. Тогда:
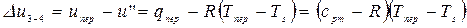 ,
,
где 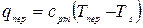 . Тогда:
. Тогда:
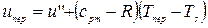 , или, т.к.
, или, т.к. 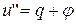 ,
,
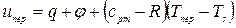 . (4)
. (4)
 2015-01-21
2015-01-21 1854
1854
