Качественной реакцией для обнаружения углекислого газа является помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
В начале реакции образуется белый осадок, который исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат:
CaCO3 + H2O + CO2 = Сa(HCO3)2.
Получение. Получают углекислый газ термическим разложением солей угольной кислоты (карбонатов), например, обжиг известняка:
CaCO3 = CaO + CO2,
или действием сильных кислот на карбонаты и гидрокарбонаты:
CaCO3 + 2HCl = CaCl2 + H2O + CO2,
NaHCO3 + HCl = NaCl + H2O + CO2.
Выбросы углекислого газа, серистых соединений в атмосферу в результате промышленной деятельности, функционирования энергетических, металлургических предприятий ведут к возникновению парникового эффекта и связанному с ним потеплению климата.
По оценкам ученых глобальное потепление без принятия мер по сокращению выбросов парниковых газов составит от 2-х до 5 градусов на протяжении следующего столетия, которое появится беспрецедентным явлением за последние десть тысяч лет. Потепления климата, увеличения уровня океана на 60-80 см до конца следующего столетия приведут к экологической катастрофе невиданного масштаба, который угрожает деградацией человеческому содружеству.
Угольная кислота и ее соли. Угольная кислота очень слабая, существует только в водных растворах и незначительно диссоциирует на ионы. Поэтому водные растворы СО2 обладают слабокислыми свойствами. Структурная формула угольной кислоты:
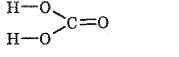
Как двухосновная, она диссоциирует ступенчато: Н2СO3Н++НСО-3 НСО-3Н++СО2-3
При нагревании она разлагается на оксид углерода (IV) и воду.
Как двухосновная кислота, она образует два типа солей: средние соли — карбонаты, кислые соли — гидрокарбонаты. Они проявляют общие свойства солей. Карбонаты и гидрокарбонаты щелочных металлов и аммония хорошо растворимы в воде.
Соли угольной кислоты — соединения устойчивые, хотя сама кислота неустойчива. Они могут быть получены взаимодействием СО2 с растворами оснований или же путем обменных реакций:
NaOH+СO2=NaHCO3
КНСO3+КОН=К2СO3+Н2O
ВаСl2+Na2CO3=BaCO3+2NaCl
Карбонаты щелочноземельных металлов в воде малорастворимы. Гидрокарбонаты, напротив, растворимы. Гидрокарбонаты образуются из карбонатов, оксида углерода (IV) и воды:
СаСO3+СO2+Н2О=Са(НСО3)2
При нагревании карбонаты щелочных металлов плавятся, не разлагаясь, а остальные карбонаты при нагревании легко разлагаются на оксид соответствующего металла и СО2:
СаСO3=СаО+CO2
Гидрокарбонаты при нагревании переходят в карбонаты:
2NaHCO3=Na2CO3+CO2+Н2О
Карбонаты щелочных металлов в водных растворах имеют сильнощелочную реакцию вследствие гидролиза:
Na2CO3+Н2О=NaHCO3+NaOH
Качественной реакцией на карбонат-ион С2-3 и гидрокарбонат НСО-3 является их взаимодействие с более сильными кислотами. Выделение оксида углерода (IV) с характерным «вскипанием» указывает на наличие этих ионов.
СаСO3+2НСl=СаСl2+CO2+Н2О
Пропуская выделяющийся СО2 через известковую воду, можно наблюдать помутнение раствора вследствие образования карбоната кальция:
Са(ОН)2+СO2=CaCO3+Н2O
При длительном пропускании СО2 раствор становится снова прозрачным вследствие
образования гидрокарбоната: СаСО3+Н2O+СO2=Са(НСO3)2
 2015-01-30
2015-01-30 3601
3601
