Гидролизом называют обменное взаимодействие соли с водой, протекающее с образованием слабого электролита или его соли. Гидролиз сопровождается изменением рН раствора. Реакция гидролиза является обратной реакции нейтрализации (реакции между кислотой и основанием). Гидролиз, как и диссоциация, может протекать ступенчато. Количественными характеристиками гидролиза являются константа гидролиза (Кг) и степень гидролиза (αг).
Степенью гидролиза (αг) называют отношение молярной концентрации прогидролизовавшейся соли (сг) к общей концентрации соли (со) в растворе, которое выражают в долях или в процентах:
αг = 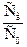 (0 < αг < 1); αг =
(0 < αг < 1); αг = 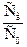 ∙100 (0 < αг < 100).
∙100 (0 < αг < 100).
В расчетных выражениях степень гидролиза выражается, как правило, в долях (т.е. в соответствии с первой формулой). Степень гидролиза возрастает с увеличением температуры и уменьшением концентрации электролита. Гидролиз протекает легче всего по первой ступени.
Константой гидролиза называется константа равновесия реакции гидролиза.
Константу гидролиза можно рассчитать, зная константу диссоциации соответствующего слабого электролита:
Кг = 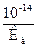 , где Кд – константа диссоциации слабого электролита.
, где Кд – константа диссоциации слабого электролита.
Константа и степень гидролиза связаны соотношением, аналогичным закону разбавления Оствальда: Кг = αг2с, где с – молярная концентрация электролита, моль/л; αг – степень гидролиза соли, долей.
Характер гидролиза растворенного вещества определяется природой соли.
Соли, образованные сильными электролитами (NaCl, K2SO4, NaNO3, KCl и др.), гидролизу не подвергаются.
Уравнение гидролиза записывают в трех видах: молекулярном, полном ионном и сокращенном ионном. Тип гидролиза определяется типом слабого электролита, а реакция раствора (кислая, щелочная, нейтральная) – типом сильного электролита.
Задача 1. Для данной соли напишите уравнения гидролиза по первой ступени в молекулярной форме, полной и краткой ионной форме, определите тип гидролиза, рассчитайте константу гидролиза, степень гидролиза и рН раствора этой соли.
| Соль и ее концентрация | ||
| а) | MgBr2 | Cм = 0,1 M |
| б) | Na2CO3 | Cм = 0,01 M |
| в) | NH4F | Cм = 0,015 M |
а) MgBr2 – соль образована слабым основанием и сильной кислотой, протекает гидролиз по катиону:
уравнение гидролиза по первой ступени в молекулярной форме:
MgBr2 + Н2О ↔ MgОНBr + НBr
уравнение гидролиза по первой ступени в краткой ионной форме:
Mg2+ + Н2О ↔ MgОН+ + Н+
уравнение гидролиза по первой ступени в полной ионной форме:
Mg2+ + 2Br -+ Н2О ↔ MgОН+ + Н+ + 2Br -
Для расчета требуется Кд основания. Т.к. на первой ступени гидролиза образуется ион MgОН+, то для расчета используется Кд2 основания (этот ион диссоциирует по второй ступени диссоциации гидроксида магния).
КГ = 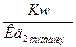 =
= 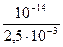 =
= 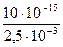 = 4∙10-12
= 4∙10-12
αГ= 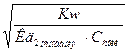 =
= 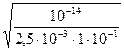 =
= 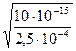 =
= 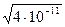 =
= 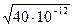 =
=
=6,32∙10-6 = 6,32∙10-4%
[H+] = 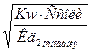 =
= 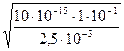 =
= 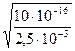 =
= 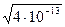 =
= 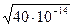 =
=
= 6,32∙10-7 моль/л
рН =-lg[Н+] = -lg(6,32∙10-7) = -0,8 +7 = 6,2 (среда раствора кислая)
б) Na2CO3 – соль образована сильным основанием и слабой кислотой, протекает гидролиз по аниону:
уравнение гидролиза по первой ступени в молекулярной форме:
Na2CO3 + Н2О ↔ NaНCO3 + NaOH
уравнение гидролиза по первой ступени в краткой ионной форме:
CO32- + Н2О ↔ HCO3- + OН -
уравнение гидролиза по первой ступени в полной ионной форме:
2Na+ + CO32- + Н2О ↔ HCO3- + OН - + 2Na+
Для расчета требуется Кд кислоты. Т.к. на первой ступени гидролиза образуется ион НCO3-, то для расчета используется Кд2 кислоты (этот ион диссоциирует по второй ступени диссоциации угольной кислоты).
КГ = 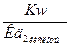 =
= 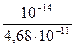 =
= 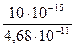 = 2,13∙10-4
= 2,13∙10-4
αГ= 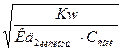 =
= 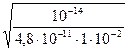 =
= 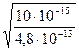 =
= 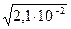 =1,4∙10-1=14%
=1,4∙10-1=14%
[H+]= 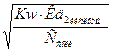 =
= 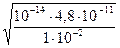 =
= 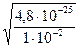 =
= 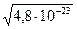 =
= 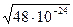 =
=
= 6,9∙10-12 моль/л
рН =-lg[Н+] = -lg(6,9∙10-12) = -0,84 +12 = 11,16 (среда раствора щелочная)
в) NH4F – соль образована слабым основанием и слабой кислотой, протекает гидролиз по катиону и аниону:
уравнение гидролиза в молекулярной форме: NH4F + Н2О ↔ NH4ОН + НF
уравнение гидролиза в ионной форме: NH4+ + F- + Н2О ↔ NH4ОН + НF
КГ = 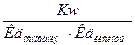 =
= 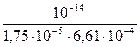 =
= 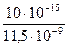 = 0,86∙10-6
= 0,86∙10-6
αГ= 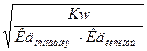 =
= 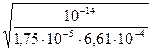 =
= 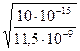 =
= 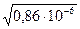 =
=
=0,9∙10-3 = 0,9∙10-1%
[H+]= 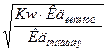 =
= 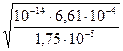 =
= 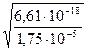 =
= 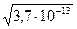 =
= 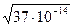 =
=
=6,08∙10-7 моль/л
рН =-lg[Н+] = -lg(6,08∙10-7) = -0,78+ 7 = 6,22(среда раствора слабокислая)
Задача 2. На сколько единиц изменится рН 0,5М раствора гидросульфита натрия (NaHSO3) при нагревании его от 0°С до 50°С?
NaHSO3 – соль образована сильным основанием и слабой кислотой, протекает гидролиз по аниону:
NaHSO3 + H2O ↔ H2SO3 + OH-
Для того, чтобы ответить на вопрос задачи, нужно рассчитать рН раствора при обеих данных температур.
1) при температуре 0°С Кw = 0,114∙10-14
[H+]= 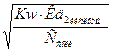 =
= 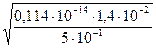 =
= 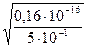 = 0,17 ∙ 10-8моль/л
= 0,17 ∙ 10-8моль/л
рН1 = - lg[H+] = - lg(0,17 ∙ 10-8) = 0,79 + 8 = 8,79
2) при температуре 50°С Кw = 5,474∙10-14
[H+]= 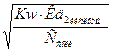 =
= 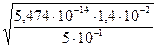 =
= 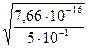 = 3,9 ∙ 10-8моль/л
= 3,9 ∙ 10-8моль/л
рН2 = - lg[H+] = - lg(3,9 ∙ 10-8) = - 0,59 + 8 = 7,40
ΔрН = рН1 – рН2 = 8,79 - 7,40 = 1,39
рН раствора изменится на 1,39 единиц.
 2015-01-30
2015-01-30 3734
3734
