Химическая термодинамика изучает энергетические эффекты реакций, их направление и пределы самопроизвольного протекания.
Объект изучения в химической термодинамике — термодинамическая система (в дальнейшем просто система) — это совокупность взаимодействующих веществ, мысленно или реально обособленная от окружающей среды.
Система может находиться в различных состояниях. Состояние системы определяется численными значениями термодинамических параметров: температуры, давления, концентраций веществ и пр. При изменении значения хотя бы одного из термодинамических параметров, например, температуры происходит изменение состояния системы. Изменение состояния системы называется термодинамическим процессом или просто процессом.
Процессы могут протекать с различными скоростями. В зависимости от условий перехода системы из одного состояния в другое, в химической термодинамике различают несколько типов процессов, простейшими из которых являются изотермический, протекающий при постоянной температуре (Т=соnst), изобарный, протекающий при постоянном давлении (р=соnst), изохорный, протекающий при постоянном объёме (V=соnst) и адиабатический, который осуществляется без обмена теплотой между системой и окружающей средой (q=соnst). Наиболее часто в химической термодинамике реакции рассматриваются как изобарно-изотермические (р=соnst, Т=соnst) или изохорно-изотермические (V=соnst, Т=соnst) процессы.
Чаще всего в химической термодинамике рассматриваются реакции, притекающие в стандартных условиях, т.е. при стандартной температуре и стандартном состоянии всех веществ. В качестве стандартной принята температура 298К. Стандартным состоянием вещества является его состояние при давлении 101,3 кПа. Если вещество находится в растворе, за стандартное принимается его состояние при концентрации 1 моль/л.
Для характеристики процессов химическая термодинамика оперирует особыми величинами, называемыми функциями состояния: U – внутренняя энергия, Н – энтальпия, S – энтропия, G – энергия Гиббса и F – энергия Гельмгольца. Количественными характеристиками любого процесса являются изменения функций состояния, которые и определяются методами химической термодинамики:? ΔU, ΔH, ΔS, ΔG, ΔF.
Термохимический расчёт заключается в определении теплового эффекта реакции (теплоты реакции). Теплотой реакции, называется количество выделенной или поглощённой теплоты q. Если в ходе реакции теплота выделяется, такая реакция называется экзотермической, если теплота, поглощается, реакция называется эндотермической.
Численное значение теплоты реакции зависит от способа её проведения. В изохорном процессе, проводимом при V=соnst, теплота реакции q V = Δ U, в изобарном процессе при р = соnst тепловой эффект q p = Δ H. Таким образом, термохимический расчёт заключается в определении величины изменения или внутренней энергии, или энтальпии в ходе реакции. Поскольку подавляющее большинство реакций протекает в изобарных условиях (например, это все реакции в открытых сосудах, протекающие под атмосферным давлением), при проведении термохимических расчётов практически всегда производится расчёт ΔН. Если Δ Н<0, то реакция экзотермическая, если же Δ Н>0, то реакция эндотермическая.
Термохимические расчёты производятся, используя следствие из закона Гесса: тепловой эффект реакции равен сумме теплот (энтальпий) образования продуктов реакции за вычетом суммы теплот (энтальпий) образования реагентов.
Запишем в общем виде уравнение реакции: аА + bВ = сС + dD. Согласно следствию из закона Гесса теплота реакции определяется по формуле:
Δ Н = (c Δ Н обр, С + d Δ Н обр,D) - (а Δ Н обр,А + b Δ Н обр,В), гдеΔ Н — теплота реакции; ΔН обр – теплоты (энтальпии) образования, соответственно, продуктов реакции С и D и реагентов А и В; с, d, а, b – коэффициенты в уравнении реакции, называемые стехиометрическим и коэффициентами.
Базовыми величинами в данной формуле являются теплоты (энтальпии) образования реагентов и продуктов. Теплотой (энтальпией) образования соединения называется тепловой эффект реакции, в ходе которой образуется 1 моль этого соединения из простых веществ, находящихся в термодинамически устойчивых фазах и модификация. Например, теплота образования воды в парообразном состоянии равна половине теплоты реакции, выражаемой уравнением: 2Н2(г) + О2(г) = 2Н2О (г). Размерность теплоты образования – кДж/моль.
В термохимических расчётах теплоты реакций, как правило, определяются для стандартных условий, для которых формула приобретает вид: ΔН°298 = (cΔН°298 обр С + dΔН°298 обр D) - (аΔН°298 о6р A + bΔН°298 обр В), где ΔН°298 – стандартная теплота реакции в кДж (стандартность величины указывается верхним индексом "О") при температуре 298К, а ΔН°298 обр. — стандартные теплоты (энтальпии) образования соединений также при температуре 298К. Значения ΔН°298обр. определены для всех соединений и являются табличными данными.
Энергией Гиббса реакции называется изменение энергии Гиббса Δ G при протекании химической реакции. Так как энергия Гиббса системы G = Н – ТS, её изменение в процессе определяется по формуле: Δ G = Δ Н – Т Δ S, где Т – абсолютная температура, К.
Энергия Гиббса химической реакции характеризует возможность её самопроизвольного протекания при постоянном давлении и температуре ( при р=соnst, Т=соnst). Если Δ G < 0, то реакция может протекать самопроизвольно, при Δ G > 0 самопроизвольное протекание реакции невозможно, если Δ G = 0, система находится в состоянии равновесия.
Для расчёта энергии Гиббса реакции отдельно определяются ΔН и ΔS. При этом в большинстве случаев используется слабая зависимость величин изменения энтальпии ΔН и энтропии ΔS от условий протекания реакции, т.е. пользуются приближениями: ΔН = ΔН°298 и ΔS = ΔS°298.
Стандартную теплоту реакции ΔН°298 определяют, используя следствие из закона Гесса, а стандартную энтропию реакции аА + bВ = сС + dD рассчитывают по формуле: ΔS°298= (сS°298 обрС + dS°298, обрD) – (aS°298 обрА + bS°298обрB), где ΔS°298 – табличные значения абсолютных стандартных энтропии соединений в Дж/(мольК), а ΔS°298 – стандартная энтропия реакции в Дж/К.
Если реакция протекает в стандартных условиях при температуре 298К, расчёт её энергии Гиббса (стандартной энергии Гиббса реакции) можно производить аналогично расчёту стандартной теплоты реакции по формуле, которая для реакции, выраженной уравнением аА + bВ = сС + dD, имеет вид:
ΔG ° 298=(сΔG ° 298 С + dΔG ° 298 D) – (аΔG ° 298 A + bΔG ° 298 B), где ΔG ° 298 — стандартная энергия Гиббса образования соединения в кДж/моль (табличные значения) – энергия Гиббса реакции, в которой при температуре 298К образуется 1 моль данного соединения, находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, а ΔG ° 298 – стандартная энергия Гиббса реакции в кДж.
Задача 1. Для данной реакции 2SO2 (г)+ O2(г) = 2SO3(г) рассчитайте изменение энтальпии ΔН298, энтропии ΔS298 и энергии Гиббса ΔG298. Рассчитайте температурную область самопроизвольного протекания реакции. Рассчитайте константу равновесия данной реакции при стандартных условиях (таблицы стандартных термодинамических потенциалов приводятся в различных справочниках).
Расчет энтальпии (ΔН298°):
ΔН°298=Σ ΔНпродуктов реакции – Σ ΔНреагентов
из приложения Таблицы стандартных термодинамических потенциалов выбираем значения ΔН°298 для веществ, участвующих в реакции и подставляем их в расчетную формулу:
ΔН°298=Σ ΔНпродуктов реакции – Σ ΔНреагентов= 2? ΔН298° (SO3)–(2? ΔН298°(SO2) +ΔН298° (O2))= =2 (−395,2) −(2 (−296,9) + 0) = − 197,2 кДж/моль
Расчет энтропии (ΔS°298):
ΔS°298=Σ ΔSпродуктов реакции – Σ ΔSреагентов
из таблицы стандартных термодинамических потенциалов выбираем значения ΔS°298 для веществ, участвующих в реакции и подставляем их в расчетную формулу:
ΔS°298=Σ ΔSпродуктов реакции – Σ ΔSреагентов =2? ΔS°298 (SO3) -(2?ΔS°298 (SO2)+ ΔS°298 (О2)) =
=2? 256,2 – (2?248,1 +205) = –188,8 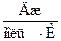 = –0,1888
= –0,1888 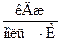 .
.
Расчет энергии Гиббса (ΔG°298):
ΔG°298= ΔН°298 – T? ΔS°298
по полученным данным рассчитываем энергию Гиббса (при стандартных условиях Т = 298К):
ΔG°298=ΔН°298–T?ΔS°298=−197,2кДж/моль – 298?(–0,1888) 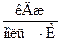 = –140,9 кДж/моль.
= –140,9 кДж/моль.
Расчет показывает, что окисление диоксида серы кислородом при 25ºC (298K) термодинамически возможный процесс (т.к.?G<0). В ходе этой реакции энтропия уменьшается и, следовательно, с ростом температуры уменьшается возможность протекания этой реакции.
Определение температурной области самопроизвольного протекания реакции.
Так как условием самопроизвольного протекания реакции является отрицательность DG (DG<0), определение области температур, в которой реакция может протекать самопроизвольно, сводится к решению неравенства (DH–TDS)
Реакция протекает самопроизвольно, если ΔG°298≤ 0, следовательно:
ΔН°298– T? ΔS°298 ≤ 0, отсюда Т ≤ 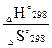 ≤
≤ 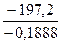 ; Т ≤
; Т ≤  1044,5 К (771,5?С),
1044,5 К (771,5?С),
т.е. при всех температурах, меньших 1044,5 К, будет обеспечиваться отрицательность DG и, следовательно, в данном температурном диапазоне будет возможным самопроизвольное протекание рассматриваемой реакции.
Расчет константы химического равновесия:
Кр = e 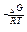 , где R=8,31
, где R=8,31 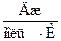 =0,00831
=0,00831 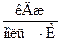 , Т = 298К.
, Т = 298К.
Рассчитываем, используя известные данные:
– 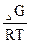 =
= 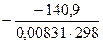 = 56,9;
= 56,9;
Кр = e 56,9 = 5,14·1024
 2015-01-30
2015-01-30 19843
19843
