Электролитами называются вещества, которые в растворе или расплаве распадаются (диссоциируют) на ионы. Вследствие диссоциации растворы и расплавы электролитов проводят электрический ток. Образование ионов в расплаве происходит в результате разрушения ионной кристаллической решётки - это физический процесс. В растворе распад электролита на ионы осуществляется в результате химического взаимодействия растворяемого электролита с молекулами растворителя.
По способности к диссоциации в растворе электролиты делятся на сильные и слабые. Сильные электролиты диссоциируют на ионы полностью, слабые – частично.
Например, если KnAm - сильный электролит. Уравнение его диссоциации записывается как уравнение необратимого процесса: KnAm = nKm+ + mAn-. Например, Al 2 (SO 4) 3 = 2Al3++3(SO 4)2-. В растворе сильного электролита концентрация его ионов определяется исключительно концентрацией раствора.
Если электролит KnAm - слабый, в его растворе устанавливается химическое равновесие между электролитом, остающимся в недиссоциированном виде, и ионами в растворе согласно уравнению: КnAm ↔ nKm+ +mAn-. Такое равновесие называется ионным. Например, H2SO3↔2H+ +SO32-.
Как и любое химическое равновесие, ионное равновесие количественнно характеризуется величиной константы равновесия, называемой константой диссоциации KKnAm, которая для слабого электролита KnAm записывается:
KKnAm= 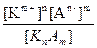 ,
,
где [Km+] и [An-]-соответственно, равновесные концентрации катионов и анионов слабого электролита, а [KnAm] - равновесная концентрация электролита, остающегося в недиссоциированном состоянии. Например, для слабой кислоты H2SO3 (уравнение её диссоциации см. выше) константой диссоциации является выражение: КH2SO3= 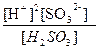 .
.
Величина константы диссоциации количественно характеризует способность слабого электролита к разложению в растворе на ионы. Из выражения константы диссоциации вытекает, что чем больше её величина, тем выше способность слабого электролита к диссоциации.
Универсальной количественной характеристикой диссоциации электролита является степень его диссоциации a, которая определяется как отношение числа молей диссоциированного электролита к общему числу молей электролита в растворе. Исходя из определения сильных и слабых электролитов, для сильных электролитов a=1(100%), для слабых - a<1(<100%). Типичные слабые электролиты, как правило, имеют значение a<0,01(<1%). Поэтому в практических расчётах концентрацию недиссоциированного слабого электролита можно считать равной общей концентрации раствора.
В общем виде для любого слабого электролита КА, диссоциирующего по уравнению КА ↔ К+ +А-, концентрации ионов в растворе находятся из соотношения: [K+]=[A-]= 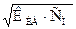 ,
,
где KKA – константа диссоциации слабого электролита, а С М – его молярная концентрация.
В отличие от константы диссоциации, величина которой зависит только от природы слабого электролита и температуры, на величину степени диссоциации слабого электролита сильное влияние оказывает также концентрация раствора, а именно, степень диссоциации увеличивается при уменьшении концентрации раствора (при его разбавлении). Эта зависимость количественно устанавливается законом разбавления Оствальда, который в практических расчётов для любого слабого электролита КА, диссоциирующего по уравнению КА↔ К+ +А-, используется в виде:a» 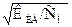 ,
,
где, KKA – константа диссоциации слабого электролита, а С М – его молярная концентрация.
В водных растворах сам растворитель – вода – является слабым электролитом. Вода диссоциирует согласно уравнению: Н2О ↔ Н+ + ОН-. При этом в обычных температурных условиях (при t=220С) в любом водном растворе концентрации ионов Н+ и ОН- взаимосвязаны, а именно:
[H+][OH-] = КН2О = 10-14.
КН2О=10-14 называется ионным произведением воды.
На практике для характеристики водных растворов электролитов пользуются не абсолютными значениями концентраций ионов Н+ и ОН- , а величиной водородного показателя (рН): рН= - lg[H+].
При [H+] = [OH–] = 10–7 моль/л (рН = рОН = 7) среда раствора нейтральная;
при [H+] > [OH–] (рН < 7) – среда кислая; при [H+] < [OH–] (pH > 7) – среда щелочная.
Задача 1. Напишите уравнения диссоциации двух данных веществ. Рассчитайте рН водных растворов обоих веществ с указанной концентрацией.
| а) | Вещества: NaOH и HNO2, Cм = 0,004 M |
| б) | Вещества: HCl и NH4OH, Cм = 0,003 M |
а) Уравнение диссоциации:
NaOH ↔ Na+ + OH-
HNO2 ↔ H+ + NO2 –
Расчет рН:
NaOH – сильное основание, поэтому [OH-] = CM(NaOH) = 0,004M =4∙10-3
рOН= -lg[OH-] = -lg(4∙10-3) = -0,6 + 3 = 2,4
рН = 14 - рOН = 14 - 2,4 = 11,6 (среда раствора щелочная)
HNO2 – слабая кислота, поэтому [H+] ≠ CM(HNO2), для расчета концентрации [H+] используется формула 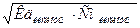 ,
,
СМ = = 0,004M =4∙10-3, Кд = 5,1∙10-4.
[H+] = 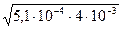 =
= 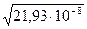 = 4,6∙10-4
= 4,6∙10-4
рН = -lg[Н+] = -lg(4,6∙10-4) = -0,67+ 4 = 3,33(среда раствора кислая).
б) Уравнение диссоциации:
HCl ↔ H+ + Cl-
NH4OH ↔ NH4+ + OH-
Расчет рН:
HCl – сильная кислота, поэтому [H+] = CM(HCl) = 0,003M =3∙10-3
рН =-lg[Н+] = -lg(3∙10-3) = -0,2 + 3 = 2,8(среда раствора кислая).
NH4OH – слабое основание, поэтому [OH-] ≠ CM(NH4OH), для расчета концентрации [OH-] используется формула 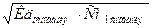 ,
,
СМ = 0,003M = 3∙10-3, Кд = 1,75∙10-5.
[ОH-] = 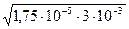 =
= 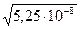 = 2,29∙10-4
= 2,29∙10-4
рОН = -lg [ОH-] = -lg(2,29∙10-4) = -0,35+ 4 = 3,65,
рН = 14 - рOН = 14 - 3,65 = 10,35(среда раствора щелочная).
 2015-01-30
2015-01-30 4614
4614








