1. Для выбора методов анализа препарата и заключения о его качестве необходимо провести оценку качества в соответствии с ГФ.
· Охарактеризуйте химическое строение лекарственного вещества, физико-химические свойства, приведите нормативные показатели, характеризующие качество лекарственного вещества. Дайте характеристику химическим свойствам и приведите основные типы реакций, используемых в анализе соединений этой группы. Дайте обоснование выбору метода количественного определения в субстанции и лекарственных формах.
· Обоснуйте возможные изменения качества лекарственного средства в процессе хранания, предложите испытания на посторонние примеси.
Для проведения аналитического контроля и заключения о качестве лекарственного средства:
1. Рибофлавин – Riboflavinum. Витамин В2 – Vitaminum В2
6,7-Диметил-9-(Д-1-рибитил)-изоаллоксазин 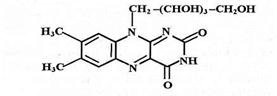
Фармакологическая группа: Средства, регулирующие метаболические процессы
Витамины
Медицинское применение: применяют при гипо- и арибофлавинозе, при конъюнктивитах, кератитах, язвах роговицы, катаракте, при длительно не заживающих ранах и язвах, общих нарушениях питания, лучевой болезни, астении, нарушениях функции кишечника, болезни Боткина и др.
Лекарственные формы: порошок, таблетки.
Химическое строение: Рибофлавин представляет собой гетероциклическую систему - изоаллоксазин и остаток рибозы. Изоаллоксазин – гетероциклическая система, включающая 2 гетероцикла (пиразин и пиримидин) и бензольный цикл, т.е. является частично гидрированным производным бензоптеридина. Пиримидиновое ядро изоаллоксазина имеет характер лактамного цикла.
Рибофлавин имеет характерную желто-оранжевую окраску, обусловленную несколькими сопряженными связями в молекуле.
Проявление витаминной активности во флавиновой системе связано с наличием в молекуле чрезвычайно лабильной азадиеновой группировки с двумя сопряженными двойными связями (в изоаллоксазиновом ядре). Эта группировка обусловливает окислительно-восстановительные свойства рибофлавина. При восстановлении рибофлавин, теряя желтую окраску, переходит в бесцветный лейкорибофлавин.. Последующее окисление обусловливает обратный процесс.
На витаминную активность оказывает влияние также наличие в молекуле рибитильного радикала.
Физико-химические свойства: Рибофлавин имеет характерную желто-оранжевую окраску, обусловленную наличием сопряженных двойных связей в молекуле. Водные растворы обладают зеленовато-желтой окраской и интенсивной желто-зеленой флюоресценцией, которая исчезает при добавлении кислоты хлороводородной или щелочи. Это свойство используется для установления подлинности рибофлавина.
Рибофлавин способен поглощать излучение как в видимой, так и в УФ-областях спектра (в водных растворах имеет 4 максимума поглощения 223, 267, 370 и 445 нм). Это свойство лежит в основе его идентификации и количественного анализа.
Для рибофлавина характерна оптическая активность, явязанная с наличием оптических центров рибитильной цепочки. Удельное вращение от -115 до -135о (0,5%-ный раствор в спиртовом растворе гидроксида калия).
1) Кислотно-основные свойства и реакции комплексообразования. Рибофлавин имеет амфотерный характер. Кислотные свойства его связаны с подвижным атомом водорода имидной группы (N3), а основные – с гетероциклическими атомами азота. Поэтому он растворим в растворах щелочей, хлороводородной и уксусной кислотах.
Рибофлавин с концентрированной серной кислотой приобретает вишнево-красное окрашивание.
Раствор нингидрина при кипячении в щелочной среде образует в присутствии рибофлавина зеленую окраску.
Как азотистое органическое основание рибофлавин реагирует с осадочными общеалкалоидными реактивами, например, реактивом Драгендорфа.
За счет комплексообразующих группировок (–С=О; –N=) рибофлавин с солями некоторых металлов (Ag+, Hg+, Cu2+, Fe2+, Co2+ и др.) образует нерастворимые интенсивно окрашенные комплексы. Например, с AgNO3 – оранжево-красного, переходящего в красный; с солями ртути (II) – оранжевого цаета.
2) Окислительно-восстановительные свойства обусловлены наличием в молекуле окислительно-восстановительной системы:
| +2H |
- N=C – C=N – ↔ - N – C=C – N -
| -2H H | H
Он восстанавливается с присоединением двух протонов и двух электронов в лейкорибофлавин (дигидрорибофлавин), теряя при этом свою желтую окраску. Дигидрорибофлавин легко реокисляется в рибофлавин уже при воздействии кислорода воздуха. Это свойство используется для его идентификации.
Хранение. Под влиянием света происходят изменения в химической структуре рибофлавина. Они зависят как от интенсивности облучения, так и от рН среды. При действии света в нейтральной или слабокислой среде происходит частичное или полное отщепление остатка рибозы с образованием люмихрома, имеющего желтое окрашивание, а в щелочной среде образуется люмифлавин (и чпстично люмихром). Люмихром и люмифлавин витаминной активности не проявляют. Следовательно, рибофлавин следует хранить в хорошо укупоренных банках оранжевого стекла.
Обнаружение примесей: Люмихром имеет желтое окрашивание, но не обладает флюоресценцией. Люмифлавин имеет окрашивание и флюоресценцию, но растворяется в хлороформе, в отличие от рибофлавина.
1)Для установления допустимого содержания примеси люмифлавина его извлекают хлороформом, затем измеряют его оптическую плотность при длине волны 440 нм.
2) Установление содержания светопоглощающих примесей: измеряют оптическую плотность растворов рибофлавина в максимумах при длинах волн 267 нм, 373 нм, 444 нм. Отношение оптических плотностей при 373 и 267 нм должно быть в пределах от 0,31 до 0,33, а при 444 и 267 нм – от 0,36 до 0,39.
1) Спектрофотометрия в УФ-области.
В водных растворах рибофлавин имеет 4 максимума поглощения: 223, 267, 370 и 445 нм. Растворитель – вода с добавлением уксусной кислоты и ацетата натрия. Определение проводят при длине волны 267 нм.
2) Алкалиметрическое определение рибофлавина после его реакции с нитратом серебра. Под действием нитрата серебра происходит замещение водорода иминогруппы ионом серебра с выделением эквивалентного количества азотной кислоты, которую оттитровывают щелочью (индикатор – бромтимоловый синий).
3) Цериметрия с йодометрическим окончанием. Раствором сульфата церия (IV) окисляют рибофлавин при кипячении, после охлаждения добавляют йодид калия и титруют выделившийся йод.
4) Метод Кьельдаля (содержание азота 14,5 – 15,2%).
5) Определение рибофлавина по рибитильной части:
- Окисление раствором периодата калия в нейтральной среде с образованием муравьиной кислоты. Ее количество эквивалентно взятому на определение рибофлавину. Выделившуюся муравьиную кислоту оттитровывают алкалиметрическим методом.
- Этерификация концентрированной серной кислотой. Затем потенциометрическим титрованием раствором КОН устанавливают избыток серной кислоты. Реакция протекает стехиометрически в соотношении 1:3.
 2015-01-30
2015-01-30 2839
2839
