К общим свойствам растворов относятся понижение давления насыщенного пара растворителя над раствором, понижение температуры замерзания, повышение температуры кипения и осмотическое давление.
Исследование свойств разбавленных растворов показало, что понижение давления пара, повышение температуры кипения и понижение температуры замерзания обусловлены только числом растворенных частиц в определенном объеме данного растворителя и не зависят от природы растворенного вещества. В этом заключается сущность законов Рауля.
В общем виде зависимость повышения температуры кипения Dtкип. и понижения температуры замерзания Dtзам. разбавленных растворов от концентрации можно записать так:
Dtкип = Кэ×Сm и Dtзам = Кк×Сm,
где Кэ и Кк – эбулиоскопическая и криоскопическая постоянные растворителя (°С × кг × моль-1 или К × кг × моль-1).
Сm – моляльность вещества в растворе (моль/кг)
В этих уравнениях моляльную концентрацию можно заменить отношением массы растворенного вещества в 1000 г растворителя (m) к молярной массе этого вещества (М). Тогда 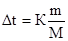
По этой формуле можно рассчитать молярную массу растворенного вещества.
Пример 1. Вычислите температуры кристаллизации и кипения водного раствора глюкозы с массовой долей С6Н12О6 2 %.
Решение. По закону Рауля: 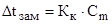 или
или 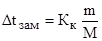 (1)
(1)
и 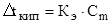 или
или 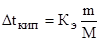 (2)
(2)
Для воды Кк = 1,86 и Кэ = 0,52
Молярная масса глюкозы 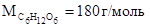
Исходя из понятия массовой доли растворенного вещества, выраженной в процентах: в 100 г раствора содержится 2 г глюкозы. Следовательно, масса растворителя будет равна: 100-2=98 г.
Найдем массу растворенного вещества в 1000 г растворителя (воды):
в 98 г воды содержится 2 г глюкозы
в 1000 г воды содержится m г глюкозы
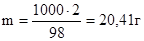
Следовательно, понижение температуры замерзания раствора по формуле (1): 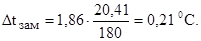
Так как 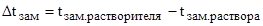 , то температура замерзания (кристаллизации) раствора равна:
, то температура замерзания (кристаллизации) раствора равна:
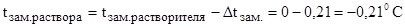 , где 0 °С - температура замерзания воды.
, где 0 °С - температура замерзания воды.
Повышение температуры кипения раствора равно по формуле (2): 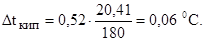
Вода кипит при 100 °С, следовательно, температура кипения этого раствора равна: 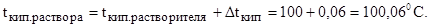
Пример 2. Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при 46,529 0С. Температура кипения сероуглерода 46,3 0С. Вычислите эбулиоскопическую константу сероуглерода.
Решение. По закону Рауля: 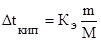 (2),
(2),
где Dtкип – повышение температуры кипения раствора равно:
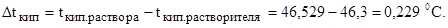
Молярная масса бензойной кислоты 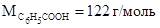
Найдем массу растворенного вещества в 1000 г растворителя:
в 100 г сероуглерода содержится 1,22 г бензойной кислоты
в 1000 г сероуглерода содержится m г бензойной кислоты
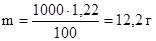
Из формулы (2) находим эбулиоскопическую константу:
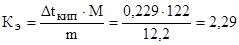
Пример 3. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при t 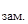 = –0,279 0С. Вычислите молярную массу глицерина.
= –0,279 0С. Вычислите молярную массу глицерина.
Решение. Из формулы (1) находим молярную массу: 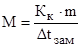
Температура кристаллизации чистой воды 0 °С, следовательно, понижение температуры кристаллизации (замерзания) равно:
Dt 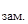 = 0 – (-0,279) = 0,279 °С
= 0 – (-0,279) = 0,279 °С
Криоскопическая константа для воды Кк = 1,86. Массу глицерина (m), приходящуюся на 1000 г воды найдем из пропорции:
в 800 г Н2О содержится 11,04 г глицерина
в 1000 г Н2О содержится m г глицерина
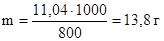
Подставляя в уравнение числовые значения Кк, m и Dt 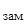 , находим молярную массу глицерина:
, находим молярную массу глицерина:
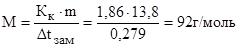
Пример 4. Вычислите массовую долю (в процентах) мочевины (NH2)2CO в водном растворе, зная, что раствор замерзает при температуре
tзам. раствора = –0,465 0С.
Решение. Температура замерзания чистой воды 00С, следовательно,
Dt 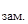 = 0 – (-0,465) = 0,465°С. Зная, что молярная масса мочевины
= 0 – (-0,465) = 0,465°С. Зная, что молярная масса мочевины 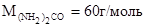 , находим массу m (г) растворенного вещества в 1000 г воды, из формулы (1):
, находим массу m (г) растворенного вещества в 1000 г воды, из формулы (1):
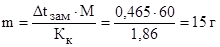
Общая масса раствора равна сумме масс растворенного вещества и растворителя: mраствора = 1000 + 15 = 1015 г.
Массовую долю мочевины в данном растворе находим из соотношения:
в 1015 г раствора содержится 15 г мочевины
в 100 г раствора содержится х г мочевины
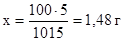
Массовая доля мочевины в водном растворе составляет 1,48 %.
ЗАДАНИЯ
161. Раствор, содержащий 0,512 г вещества в 100 г бензола, кристаллизуется при 5,296 0С. Температура кристаллизации бензола 5,5 0С. Криоскопическая константа 5,1. Вычислите молярную массу растворенного вещества.
162. Вычислите массовую долю (в процентах) сахара С12Н22О11 в водном растворе, зная температуру кристаллизации этого раствора
t 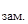 = -0,93 0С. Криоскопическая константа воды 1,86.
= -0,93 0С. Криоскопическая константа воды 1,86.
163. Вычислите температуру кристаллизации раствора мочевины (NH2)2CO, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды равна 1,86.
164. Раствор, содержащий 3,04 г камфоры С10Н16О в 100 г бензола, кипит при 80,714 0С. Температура кипения бензола 80,2 0С. Вычислите эбулиоскопическую константу бензола.
165.Вычислите массовую долю (в процентах) глицерина С3Н5(ОН)3 в водном растворе, зная, что этот раствор кипит при 100,39 0С. Эбулиоскопическая константа воды 0,52.
166. Вычислите молярную массу вещества, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при
t 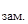 = – 0,279 0С. Криоскопическая константа воды 1,86.
= – 0,279 0С. Криоскопическая константа воды 1,86.
167. Вычислите температуру кипения раствора нафталина С10Н8 в бензоле с массовой долей С10Н8 5 %. Температура кипения бензола 80,2 °С. Эбулиоскопическая константа бензола равна 2,57.
168. Раствор, содержащий 25,65 г некоторого вещества в 300 г воды, кристаллизуется при t 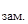 = – 0,465 0С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86.
= – 0,465 0С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86.
169. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 3,56 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,718 0С. Температура кристаллизации уксусной кислоты 16,65 0С.
170. Равные массовые количества камфоры С10Н16О и нафталина С10Н8 растворены в одинаковых количествах бензола. Какой из этих растворов кипит при более высокой температуре?
171. Температура кристаллизации раствора, содержащего 66,3 г некоторого вещества в 500 г воды, равна t 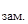 = –0,558 0С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86.
= –0,558 0С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86.
172. Сколько граммов анилина С6Н5NH2 следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53 0С. Эбулиоскопическая константа этилового эфира 2,12.
173. Вычислите температуру кристаллизации водного раствора этилового спирта с массовой долей С2Н5ОН 2 %. Криоскопическая константа воды 1,86.
174. Сколько граммов мочевины (NH2)2CO следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,4650С? Криоскопическая константа воды 1,86.
175. Вычислите массовую долю (в процентах) глюкозы С6Н12О6 в водном растворе, зная, что этот раствор кипит при 100,26 0С. Эбулиоскопическая константа воды 0,52.
176. Сколько граммов фенола С6Н5ОН следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7 0С? Криоскопическая константа бензола 5,1.
177.Сколько граммов мочевины (NH2)2CO следует растворить в 250 г воды, чтобы температура кипения повысилась на 0,26 0С? Эбулиоскопическая константа воды 0,52.
178. При растворении 2,3 г некоторого вещества в 125 г воды температура кристаллизации понижается на 0,372 0С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86.
179. Вычислите температуру кипения водного раствора пропилового спирта с массовой долей С3Н7ОН 15 %. Эбулиоскопическая константа воды 0,52.
180. Вычислите массовую долю (в процентах) метанола СН3ОН в водном растворе, температура кристаллизации которого tзам = –2,79 0С. Криоскопическая константа воды 1,86.
 2015-01-30
2015-01-30 2810
2810








