Гидролиз солей – процесс обменного взаимодействия ионов соли с водой, приводящий к образованию слабого электролита. Катион или анион соли (или оба вида ионов одновременно) могут связывать соответственно гидроксид анион ОН- или катион водорода Н+ воды (либо те и другие) с образованием малодиссоциирующего соединения (основания, кислоты, гидроксокатиона основной соли, гидроаниона кислой соли, малорастворимого соединения). При этом происходит смещение равновесия диссоциации воды и изменяется рН раствора. При связывании иона Н+ воды ионом соли в растворе накапливаются ионы ОН-, реакция среды будет щелочная, а при связывании ионов ОН- - накапливаются ионы Н+ и реакция среды будет кислая. Кислотность или щелочность среды характеризует водородный показатель рН, который равен отрицательному десятичному логарифму концентрации ионов водорода (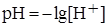 ). В кислых растворах рН < 7, и чем меньше рН, тем более кислую среду имеет раствор. В щелочных растворах рН > 7, и чем больше рН, тем больше щелочность раствора. В нейтральной среде рН = 7.
). В кислых растворах рН < 7, и чем меньше рН, тем более кислую среду имеет раствор. В щелочных растворах рН > 7, и чем больше рН, тем больше щелочность раствора. В нейтральной среде рН = 7.
Гидролизу в водных растворах подвергаются соли, содержащие катионы слабых оснований и анионы слабых кислот. Соли, содержащие катионы сильных оснований и анионы сильных кислот в водных растворах практически не гидролизуются, так как в системе имеется лишь один слабый электролит Н2О, поэтому отсутствует возможность связывания ионов Н+ и ОН- воды ионами соли.
Гидролиз солей – процесс обратимый, однако если продукты гидролиза покидают сферу реакции (выделяются в виде осадка или газа), то гидролиз протекает необратимо.
При составлении ионно-молекулярных уравнений реакции гидролиза следует: определить силу основания и кислоты, образующих данную соль; записать уравнение диссоциации соли и сделать вывод о том, какой ион (или ионы) гидролизуются; написать ионно-молекулярное уравнение гидролиза, учитывая, что вода – слабый электролит и что сумма зарядов должна быть одинаковой в обоих частях уравнения. Следует также учитывать, что гидролиз солей, образованных слабыми многоосновными кислотами и сильными основаниями (например, Na2S, K3PO4, Na2SO3, K2CO3) или солей, образованных слабыми многокислотными основаниями и сильными кислотами (например, Cu(NO3)2, CuCl2, AlCl3, ZnSO4) протекает ступенчато в соответствии с величиной заряда аниона или катиона. Но в обычных условиях практически протекает только первая ступень гидролиза, так как в результате ее образуется наиболее слабый электролит (гидроанион или гидроксокатион) из образующихся слабых электролитов по всем стадиям гидролиза. Также при первой стадии гидролиза в растворе создается значительная концентрация продуктов гидролиза – ионов ОН- или Н+, подавляющих следующие стадии гидролиза и смещая их равновесие, согласно принципу Ле - Шателье, практически нацело влево. При нагревании и разбавлении раствора гидролиз усиливается и становятся заметными следующие стадии гидролиза.
Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: а) KCN; б) Na2CO3; в) ZnSO4; г) NH4F; д) KCl. Определите реакцию среды растворов этих солей.
Решение. а) Цианид калия KCN – соль слабой одноосновной кислоты НCN и сильного основания КОН. При растворении в воде молекулы соли полностью диссоциируют: КСN ® K+ + CN -. Катионы K+ не могут связывать ионы ОН - воды, так как КОН – сильный электролит. Анионы CN – связывают ионы Н+ воды, образуя молекулы слабого электролита НCN. Соль гидролизуется по аниону. Ионно-молекулярное уравнение реакции гидролиза:
CN - + Н2О Û НCN + ОН - или в молекулярной форме:
KCN + Н2О Û НCN + КОН.
В результате гидролиза в растворе появляется избыток гидроксид - ионов ОН-, поэтому раствор KCN имеет щелочную реакцию (рН > 7).
б) Карбонат натрия Na2CO3 – соль слабой многоосновной кислоты Н2CO3 и сильного основания NaOH. При растворении в воде соль диссоциирует: Na2CO3 ® 2Na+ + СО 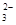 . Катионы Na+ не могут связывать ионы ОН- воды в молекулы NaOH, так как NaOH – сильный электролит. Соль гидролизуется по аниону. Карбонат - анион СО
. Катионы Na+ не могут связывать ионы ОН- воды в молекулы NaOH, так как NaOH – сильный электролит. Соль гидролизуется по аниону. Карбонат - анион СО 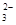 связывает катион водорода одной молекулы воды в слабодиссоциирующий гидрокарбонат - ион НСО
связывает катион водорода одной молекулы воды в слабодиссоциирующий гидрокарбонат - ион НСО 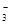 , который является более слабым электролитом, чем молекула Н2СО3. Поэтому при обычных условиях гидролиз практически протекает по первой ступени.
, который является более слабым электролитом, чем молекула Н2СО3. Поэтому при обычных условиях гидролиз практически протекает по первой ступени.
Ионно-молекулярное уравнение гидролиза:
CО32 - + НОН Û НCО3 - + ОН -
Образующиеся гидроксид – ионы обуславливают щелочную среду раствора, рН > 7.
Для составления уравнения в полной ионно-молекулярной форме приписываем противоионы Na+ в обе части уравнения:
2Na+ + CO3- + HOH Û Na+ + HCO3- + Na+ + OH-
Молекулярное уравнение гидролиза:
Na2CО3 + Н2О Û NaНCО3 + NaОН
В результате гидролиза образуются кислая соль NаHCO3 - гидрокарбонат натрия и основание NaOH.
в) Сульфат цинка ZnSO4 – соль слабого многокислотного основания Zn(OН)2 и сильной кислоты Н2SO4 . Соль в растворе диссоциирует: ZnSO4 ® Zn2+ + SO42-. Сульфат - анион SO42- не может связывать катионы водорода воды в молекулы Н2SO4, так как серная кислота – сильный электролит.
Гидролиз протекает по катиону Zn2+. Катион Zn2+, взаимодействуя с одной молекулой воды, связывает гидроксид – анион ОН- воды, образуя гидроксокатион цинка ZnОН+, который является более слабым электролитом, чем молекулы Zn(OH)2. Поэтому при обычных условиях гидролиз протекает практически по первой ступени.
Ионно-молекулярное уравнение гидролиза
Zn2+ + НОН Û ZnОН+ + Н+
Катионы водорода Н+ обуславливают кислую среду раствора (рН<7).
Приписываем противоионы SO42- и уравниваем по числу атомов элементов и числу зарядов левую и правую части уравнения
2Zn2+ + 2SO42- + 2HOH Û 2ZnOH+ + SO42- + 2H+ + SO42-
Молекулярное уравнение гидролиза:
2ZnSO4 + 2НОН Û (ZnОН)2SO4 + Н2SO4
В результате гидролиза по I ступени образуются основная соль (ZnОН)2SO4 - сульфат гидроксоцинка и серная кислота.
г) Фторид аммония NH4F – соль слабого основания NH4OH и слабой кислоты HF.
Гидролиз этой соли происходит и по катиону, и по аниону. При этом образуются слабое основание и слабая кислота.
Ионно-молекулярное уравнение гидролиза:
NH4+ + F - + H2О Û NH4ОН + HF
Молекулярное уравнение гидролиза:
NH4F + H2О Û NH4ОН + HF
Характер среды в этом случае определяется относительной силой образовавшихся слабой кислоты и слабого основания.
д) хлорид калия KCl – соль сильного основания KOH и сильной кислоты HCl.
Молекулярное уравнение реакции:
KCl + H2O Û KOH + HCl
Полное ионно-молекулярное уравнение:
K+ + Cl - + H2O Û K+ + OH - + H+ + Cl -
Сокращенное ионно-молекулярное уравнение:
H2O Û Н+ + OH -
Полученное уравнение показывает, что ни катион, ни анион соли гидролизу не подвергаются. Раствор этой соли имеет нейтральную реакцию среды, рН = 7.
Пример 2. При смешивании растворов Al(NO3)3 и K2CO3 каждая из солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями.
Решение. Al(NO3)3 – соль сильной одноосновной кислоты и слабого многокислотного основания гидролизуется по катиону, а K2CO3 – соль сильного однокислотного основания и слабой двухосновной кислоты гидролизуется по аниону. Гидролиз этих солей обычно ограничивается первой ступенью:
Al3+ + НОН Û AlОН2+ + Н+
CO32- + НОН Û НCO3- + ОН-
При смешивании растворов этих солей ионы ОН- и Н+ образуют молекулы слабого электролита Н2О, что приводит к взаимному усилению гидролиза каждой из солей. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет необратимо до конца с образованием малорастворимого гидроксида алюминия Al(ОН)3 и Н2CO3 – неустойчивой кислоты, распадающейся на CO2 и Н2О.
Ионно-молекулярное уравнение:
2Al3+ + 3CO32- + 3Н2О = 2Al(ОН)3¯ + 3CO2
Молекулярное уравнение:
2Al(NO3)3 + 3K2CO3 + 3Н2О = 2Al(ОН)3¯ + 3CO2 +6КNO3.
ЗАДАНИЯ
201. Какие из солей KJ, Na2SO3, ZnSO4, NH4Cl подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Укажите значение рН (>7<) растворов этих солей.
202. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей MnCl2, Na2CO3, Ca(NO3)2, NH4CH3COO. Какое значение рН (>7<) имеют растворы этих солей?
203. Какие из солей (NН4)2SО4, K2S, Pb(NO3)2, LiCl подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Укажите значения рН (>7<) растворов этих солей.
204. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Na2S, NH4NO3, FeSO4, CsBr. Какое значение рН (>7<) имеют растворы этих солей?
205. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей CH3COOK, ZnSO4, Na3PO4, KNO3. Какое значение рН (>7<) имеют растворы этих солей?
206. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Li2S, AlCl3, (CH3COO)2Ba, NH4CN. Какое значение рН (>7<) имеют растворы этих солей?
207. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Pb(NO3)2, Na2CO3, Na2SO4, KNO2. Какое значение рН (>7<) имеют растворы этих солей?
208. При смешивании растворов CrCl3 и Na2CO3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярными и молекулярными уравнениями.
209. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Cs3PO4, CuSO4, NaCN, (NH4)2CO3. Какое значение рН (>7<) имеют растворы этих солей?
210. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Al(NO3)3, Cs2CO3, LiBr, CH3COOK. Какое значение рН (>7<) имеют растворы этих солей?
211. При смешивании растворов К2S и CrCl3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями.
212. Какие из солей KNO3, Cr(NO3)3, (NH4)2S, Na3PO4 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Укажите значения рН (>7<) растворов этих солей.
213. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Cs2CO3, NiCl2, NH4CH3COO, LiNO2. Какое значение рН (>7<) имеют растворы этих солей?
214. Какие из солей NaJ, CrCl3, K2SiO3, (NH4)2SO3 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Укажите значения рН (>7<) растворов этих солей.
215. Какие из солей NaBr, CH3COOК, Na2S, NiSO4 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Укажите значения рН (>7<) растворов этих солей.
216. При смешивании растворов Al2(SO4)3 и Na2S каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Составьте ионно-молекуляные и молекулярные уравнения происходящего совместного гидролиза.
217. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей (NH4)2S, Cs2SiO3, Al2(SO4)3, NaCN. Какое значение рН (>7<) имеют растворы этих солей?
218. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей K3PO4, Mg(NO3)2, (NH4)2СO3, CH3COOLi. Какое значение
рН (>7<) имеют растворы этих солей?
219. Какие из солей K2CO3, FeCl3, K2SO4, NH4J подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Укажите значения рН (>7<) растворов этих солей.
220. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Al2(SO4)3, Na2S, NH4CN, KBr. Какое значение рН (>7<) имеют растворы этих солей?
 2015-01-30
2015-01-30 5571
5571
