Водородная связь – одна из разновидностей взаимодействия между полярными молекулами, образуется между электроотрицательными атомами одной молекулы и атомами водорода другой, типа Н-Х (Х – это F, O, N, Cl, Br, I) за счет сил электростатического притяжения.
Связь между водородом и одним из этих атомов характеризуется достаточной полярностью, поскольку связующее электронное облако смещено в сторону более электроотрицательного атома. Водород в данном случае расположен на положительном конце диполя. Два и более таких диполя взаимодействуют между собой так, что ядро атома водорода одной молекулы (положительный конец диполя) притягивается неподеленной электронной парой второй молекулы. Данная связь проявляется в газах, жидкостях и твердых телах.
Она относительно прочна. Наличие водородной связи обусловливает повышение устойчивости молекул вещества, а также повышению их температуры кипения и плавления. Образование водородных связей играет важную роль как в химических, так и в биологических системах.
Водородная связь бывает внутри- и межмолекулярной (рис. 14), молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей.
а 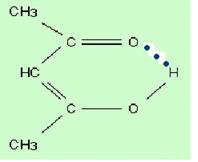 | б 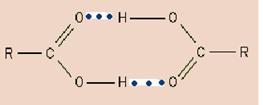 |
Рис. 14. Образование водородной связи: а – внутримолекулярной; б – межмолекулярной.
Существование веществ в различных агрегатных состояниях свидетельствует о том, что между частицами (атомы, ионы, молекулы) имеет место взаимодействие, обусловленное ван-дер-ваальсовыми силами притяжения. Наиболее важной и отличительной чертой этих сил является их универсальность, так как они действуют без исключения между всеми атомами и молекулами.
Водородные связи влияют на физические (т.кип. и т.пл., летучесть, вязкость, спектральные характеристики) и химические (кислотно-основные) свойства соединений.
Межмолекулярные водородные связи обусловливают ассоциацию молекул, что приводит к повышению температур кипения и плавления вещества. Например, этиловый спирт C2H5OH, способный к ассоциации, кипит при +78,3°С, а диметиловый эфир СН3ОСН3, не образующий водородных связей, лишь при 24°С (молекулярная формула обоих веществ С2Н6О).
Образование Н-связей с молекулами растворителя способствует улучшению растворимости. Так, метиловый и этиловый спирты (CH3OH, С2Н5ОН), образуя Н-связи с молекулами воды, неограниченно в ней растворяются.
Внутримолекулярная водородная связь образуется при благоприятном пространственном расположении в молекуле соответствующих групп атомов и специфически влияет на свойства. Например, Н-связь внутри молекул салициловой кислоты повышает ее кислотность.
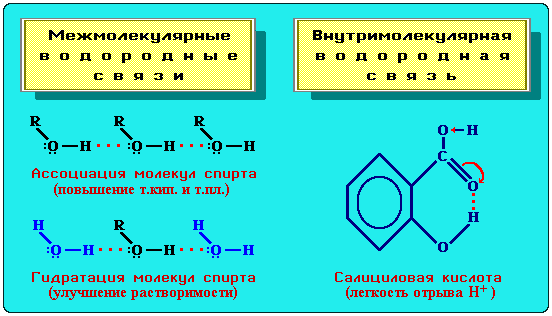
Водородные связи и их влияние на свойства вещества
Также в настоящее время есть мнение, что водородная химическая связь бывает слабой и сильной.
Они отличаются друг от друга по энергии и длине связи (расстояние между атомами):
1. Водородные связи слабые. Энергия – 10-30 кДж/моль, длина связи – 30. Все вещества, перечисленные выше, являются примерами нормальной или слабой водородной связи.
2. Водородные связи сильные. Энергия – 400 кДж/моль, длина – 23-24.
 2015-01-30
2015-01-30 20415
20415
