Жесткость воды это совокупность свойств, обусловленная наличием в ней катионов кальция Са2+ и магния Mg2+. Сумму концентраций Са2+ и Mg2+ называют общей жесткостью. Величину жесткости выражают в ммоль экв/дм3 или в моль экв/м3. Общую жесткость определяют титрованием стандартным раствором ЭДТА в щелочной среде (рН = 10) в присутствии индикатора эриохромового черного Т.
Реактивы и оборудование. Титрант – стандартный раствор ЭДТА; коническая колба для титрования объемом 250 см3; пипетка на 50,00 см3; бюретка объемом 25 см3; индикатор эриохромовый черный Т; аммиачный буфер рН = 10.
Выполнение работы
1. Готовят бюретку для титрования и заполняют ее стандартным раствором ЭДТА.
2. Пипеткой отбирают 50,0 см3 водопроводной воды и переносят ее в колбу для титрования и приливают 1 см3 аммиачного буфера рН = 10.
3. Добавляют на кончике шпателя кристаллы индикатора и начинают титрование. Последние порции ЭДТА приливают по каплям. Титрование останавливают в тот момент, когда произойдет резкий переход окраски от фиолетовой к синей.
4. Записывают объем раствора ЭДТА, пошедший на титрование. Повторяют титрование еще 3 раза. Перед каждым титрованием коническую колбу моют и ополаскивают дистиллированной водой.
Примечания
1. Буферный раствор приливают обязательно перед добавлением индикатора.
2. Индикатора не следует добавлять слишком много, иначе окраска изменяется медленно и раствор оказывается перетированым.
3. Вблизи точки эквивалентности титруют с маленькой скоростью.
4. Для ускорения титрования вблизи точки эквивалентности раствор можно нагреть до 60 оС.
Запись данных опыта и расчеты. Данные записать по приведенной ниже форме.
Таблица. Определение общей жесткости воды
Определяемое вещество – Са2+, Mg2+
Титрант – раствор ЭДТА С(1/1[ЭДТА]) =
Индикатор – эриохромовый черный Т
| № п/п | Объем воды V(Н2О), см3 | Эквивалентный объем титранта V(ЭДТА), см3 |
По результатам титрования найти средний объем титранта 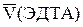 =
=
Рассчитать общую жесткость воды по уравнению
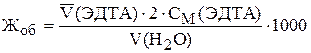 =
=
Контрольные вопросы
1. Использование комплексообразования в химическом анализе. Требования к реакциям комплексообразования в титриметрии.
2. Комплексоны и их свойства: условные константы устойчивости и их практическое значение, обоснование выбора оптимальных условий титрования.
3. Реакции комплексообразования ионов металлов с ЭДТА: оптимальные условия комплексонометрического титрования, обеспечение избирательности комплексонометрии.
4. Построение кривой титрования ионов Ni2+ трилоном Б.
5. Металлоиндикаторы, сущность их действия, основные требования к металлоиндикаторам. Выбор индикатора для конкретного определения.
6. Аналитические возможности комплексонометрического метода. Применение комплексонов в качестве маскирующего реагента.
 2015-01-30
2015-01-30 1117
1117
