1)KAl(SO4)2 а) 3 иона
2)Fe2(SO4)3 б) 2 иона
3)CrBr3 в) 4 иона
4)AlCl3 г) 5 ионов
д) 6 ионов
Установите правильную последовательность действий:
39. При составлении ионных уравнений реакций необходимо:
1) записать схему реакции
2) определить силу электролита
3) расписать сильные электролиты на ионы
4) уравнять атомы
5) сократить одинаковые ионы
 6) записать кратное ионное уравнение
6) записать кратное ионное уравнение
7) в виде молекул записать ((осадки); (газы); слаб.эл-ты)
Укажите номер правильного ответа:
 40. Краткое ионное уравнение имеет вид: 2H+ + CO2-3 CO2 + H2O при взаимодействии:
40. Краткое ионное уравнение имеет вид: 2H+ + CO2-3 CO2 + H2O при взаимодействии:
 1) (NH4)2CO3 + HBr
1) (NH4)2CO3 + HBr
 2) Li2CO3 + H2SiO3
2) Li2CO3 + H2SiO3
 3) CaCO3 + H2SO4
3) CaCO3 + H2SO4
 4) BaCO3 + HCl
4) BaCO3 + HCl
 41. Уравнению реакции Cu(OH)2 + H2SO4 CuSO4 + 2H2O соответствует сокращенное ионное уравнение:
41. Уравнению реакции Cu(OH)2 + H2SO4 CuSO4 + 2H2O соответствует сокращенное ионное уравнение:
 1) 2H+ + 2OH- 2H2O
1) 2H+ + 2OH- 2H2O
 2) Cu(OH)2 + 2H+ Cu2+ + 2H2O
2) Cu(OH)2 + 2H+ Cu2+ + 2H2O
 3) Cu2+ + SO42- CuSO4
3) Cu2+ + SO42- CuSO4
 4) Cu2+ + H2SO4 CuSO4 + 2H+
4) Cu2+ + H2SO4 CuSO4 + 2H+
42. С уменьшением концентрации соли степень диссоциации
1) возрастает 2) уменьшается 3) не изменится
Дополните:
43. В результате гидролиза соли образуется электролит _______
44. Гидролиз соли протекает по катиону, если соль образована основанием________, кислотой _________ и рН = _______
45. Гидролизу не подвергаются соли, образованные __________
Укажите номер правильного ответа:
46. Полному гидролизу подвергается:
1) AlCl3 3)KCl
2) ZnCl2 4) Al2S3
47. Гидролизу не подвергается:
1) Na2CO3 3) Na3PO4
2) NaBr 4) Na2SiO3
Дополните:
48. Степень окисления – это ______________
49. Окисление – процесс _____________
50. Если алгебраическая величина (С.О.) уменьшается, то протекает процесс___
51. Восстановитель в ходе окислительно-восстановительной реакции _________
52. Сложное вещество, содержащее элемент в высшей степени окисления играет роль _______________
53. Ме – простые вещества являются ______________
54. Чем меньше величина 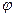 о, тем сильнее выражены свойства __________
о, тем сильнее выражены свойства __________
55. ЭДС рассчитывают по формуле __________; ЭДС > 0, то ____________
Установите соответствие:
56. Окислительно-восстановительная реакция Тип
 1) 2KNO3 2KNO2 + O2 a) сопропорционирования
1) 2KNO3 2KNO2 + O2 a) сопропорционирования
 2) 2NO2 + H2O HNO3 + HNO2 б) внутримолекулярная
2) 2NO2 + H2O HNO3 + HNO2 б) внутримолекулярная
 3) 4NH3 + 5O2 4NO + 6H2O в) диспропорционирования
3) 4NH3 + 5O2 4NO + 6H2O в) диспропорционирования
 4) 2Na2S+Na2SO3+3H2SO4 3S+3Na2SO4+3H2O г) межмолекулярная
4) 2Na2S+Na2SO3+3H2SO4 3S+3Na2SO4+3H2O г) межмолекулярная
Укажите номер правильного ответа:
57. В кислой среде (С.О.) марганца в KMnO4 изменяется до:
1) Mn0 2) Mn+2 3) Mn+4 4) Mn+6
58. Вещество проявляет только окислительные свойства:
1) Сr2(SO4)3 2) Сr0 3) СrSO4 4) K2Сr2O7
59. Окислительно-восстановительную двойственность проявляет:
1) H2SO4 2) Na2SO3 3) Na2SO4 4) H2S
Дополните:
60. Анод – электрод, на котором протекает процесс__________
61. На границе Металл – раствор возникает ______ прилегающий слой жидкости заряжается __________
62. Полуэлементом называют __________
63. Стандартный (нормальный) электродный потенциал металла – это _______
64. В цинковом полуэлементе, условно-графическая схема которого ______, процесс возникновения электродного потенциала отражает xим. уравнение ___
65. Если возрастает концентрация ионов металла в растворе, то электродный потенциал __________
66. Уравнение Нернста при Т = 298 К имеет вид ________
67. j катода ___ j анода.
 2015-01-07
2015-01-07 806
806








