1. Определите изменение энтропии в следующих реакциях:
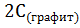 +
+ 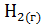
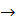
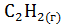
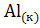 +
+ 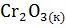
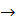 Cr +
Cr + 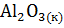
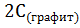 +
+ 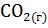
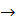
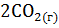
2. Определите 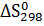 системы
системы 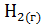 +
+ 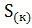 =
= 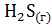 .
.
3. Рассчитайте 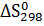 реакции разложения бертолетовой соли, если
реакции разложения бертолетовой соли, если 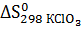 = 142,97 Дж
= 142,97 Дж 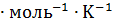 , а
, а 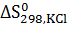 = 82,68 Дж
= 82,68 Дж 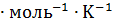 .
.
4. В каком состоянии энтропия 1 моль вещества больше: в кристаллическом или в парообразном при той же температуре?
5. Вычислите 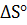 в ходе реакции:
в ходе реакции:
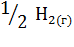 +
+ 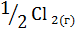 =
= 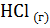 .
.
6. Определите 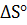 системы
системы 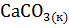 =
= 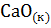 +
+ 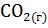 .
.
7. Подсчитав 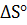 реакции, определите, какая из двух реакций термодинамически возможна: FeO + CO = Fe +
реакции, определите, какая из двух реакций термодинамически возможна: FeO + CO = Fe + 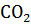 ; Fe +
; Fe + 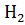 = Fe +
= Fe + 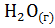 .
.
8. Как изменяется в ряду MgO 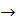 CaO
CaO 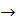 SrO
SrO 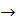 BaO устойчивость оксидов и как это согласуется со значением
BaO устойчивость оксидов и как это согласуется со значением 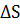 образования рассматриваемых карбонатов из оксидов?
образования рассматриваемых карбонатов из оксидов?
9. Рассчитайте изменение энтропии для следующей реакции:
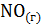 +
+ 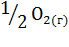
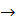
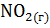 .
.
Возможно ли принудительное осуществление этой реакции при 250С?
10. Рассчитайте 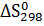 следующих реакций:
следующих реакций:
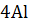 +
+ 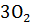 =
= 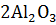 ;
;
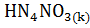 =
= 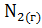 +
+ 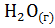 +
+ 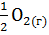
Сделайте вывод о возможности протекания реакций.
11. Составьте уравнения реакций термического распада:
1) 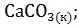 2)
2) 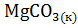 ; 3)
; 3) 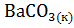 на оксиды
на оксиды 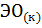 и
и 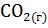 .
.
Рассчитайте 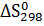 термического распада этих соединений. Расположите карбонаты в ряд по их термической устойчивости.
термического распада этих соединений. Расположите карбонаты в ряд по их термической устойчивости.
12. Декарбонизация доломита протекает по схемам:
а) 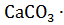
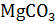 = CaO + MgO +
= CaO + MgO + 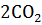
б) 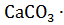
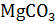 = MgO +
= MgO + 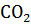 +
+ 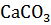
а) 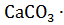
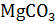 = CaO +
= CaO + 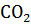 +
+ 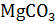
Рассчитайте 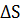 данных реакций и сделайте вывод о возможности их протекания при стандартных условиях.
данных реакций и сделайте вывод о возможности их протекания при стандартных условиях.
13.Определите, пойдет ли самостоятельно процесс кристаллизации воды при температуре 263 К. Определение произвести на основании изменения энтропии.
14. Реакция протекает по схеме: CaO + 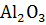 = CaO
= CaO 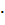
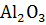
Определите 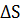 данной реакции и сделайте вывод о возможности ее протекания при Т=298 К.
данной реакции и сделайте вывод о возможности ее протекания при Т=298 К.
15. Определить изменение энтропии ƴ-α-модификационного превращения 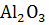 при 298 К.
при 298 К.
16. Определите изменение энтропии β-α-модификационного превращения кварца при температуре 846 К.
17. Определите изменение энтропии при переходе α- 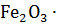
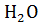 (гетит) в гематит α-
(гетит) в гематит α- 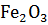 при температуре 1073 К.
при температуре 1073 К.
Сделайте вывод о возможности модификационного превращения.
18.Вычислите 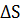 превращения переохлажденной воды в лед при температуре 268 К.
превращения переохлажденной воды в лед при температуре 268 К.
19. Полиморфные превращения ортосиликата кальция протекают по схеме:
ƴ - 2 CaO 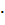
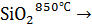 α - 2 CaO
α - 2 CaO 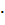
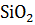
На основании рассчитанного значения 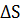 сделайте вывод о возможности данного процесса.
сделайте вывод о возможности данного процесса.
20. По известным значениям стандартной энтропии для приведенных ниже реакций определите, какие из этих реакций являются термодинамически возможными в изолированной системе:
а) 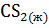 + 3
+ 3 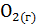 =
= 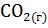 +
+ 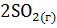
б) 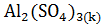 =
= 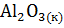 +
+ 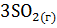 .
.
21. Энтропия реакции зависит не только от химической индивидуальности реагентов и продуктов, сколько от агрегатного состояния веществ и их количеств, участвующих в реакции.
Укажите, какое значение (>0,<0) имеет стандартная энтропия реакций:
а) 2 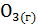 = 3
= 3 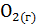 ;
;
б) 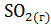 + 2
+ 2 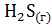 = 2
= 2 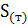 + 2
+ 2 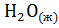
в) 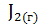 = 2
= 2 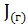
Подтвердите Ваш ответ расчетом с использованием справочных данных.
22. Определите, какому агрегатному состоянию соответствует каждое значение S  для веществ:
для веществ:
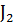 S
S  = 137; 261; 116 Дж
= 137; 261; 116 Дж 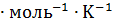
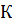 S
S  = 160; 71; 65 Дж
= 160; 71; 65 Дж 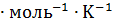
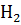 О S
О S  = 39; 70; 189 Дж
= 39; 70; 189 Дж 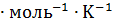
23. Укажите, какое значение(>0,<0, =0) будет иметь стандартная энтропия необратимых фазовых переходов:
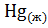 =
= 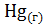 ;
; 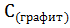 =
= 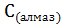 ;
; 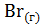 =
= 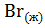 ;
; 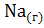 =
= 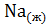 ;
; 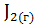 =
= 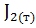 .
.
24. Как изменится энтропия изолированной системы, в которой находится равновесная смесь:
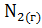 +
+ 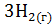

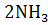 ?
?
25. В изолированной системе протекает следующий процесс:
3 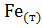 +
+ 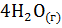 =
= 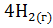 +
+ 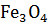 .
.
На основании определенного значения 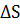 укажите направление реакции.
укажите направление реакции.
 2015-01-13
2015-01-13 1140
1140
