При проведении расчетов процессов и аппаратов химической технологии часто приходится определять количество подведенной или отведенной теплоты. Наиболее просто это сделать, используя теплоемкость теплоносителей.
Удельной теплоемкостью называется количество теплоты, которое необходимо подвести к единице количества вещества, чтобы изменить его температуру на 1 градус. В связи с этим определением различают:
- удельную массовую теплоемкость
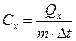 ,
, 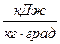 , откуда
, откуда 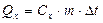 , кДж; (1)
, кДж; (1)
- удельную объемную теплоемкость
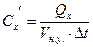 ,
, 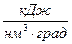 , откуда
, откуда 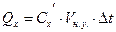 , кДж; (2)
, кДж; (2)
- удельную мольную теплоемкость
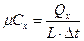 ,
, 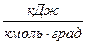 , откуда
, откуда 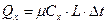 , кДж, (3)
, кДж, (3)
где m – масса газа, кг;
Vн.у ., нм3 – объем газа, приведенный к нормальным условиям (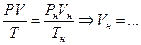 , Рн =760 мм рт. ст.=1,013×105 Па, Тн =273 К);
, Рн =760 мм рт. ст.=1,013×105 Па, Тн =273 К);
L – число киломолей вещества (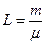 ), кмоль;
), кмоль;
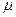 - молекулярная масса газа, кг/кмоль;
- молекулярная масса газа, кг/кмоль;
х – индекс, указывающий характер процесса подвода теплоты Qx, например, при 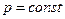 (Qp), при
(Qp), при 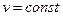 (Qv).
(Qv).
Поэтому различают:
Ср – изобарная теплоемкость,
Сv – изохорная теплоемкость.
Эти теплоемкости для идеальных газов связаны уравнением Майера:
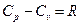 . (4)
. (4)
| |||
| |||


|
|
|
|
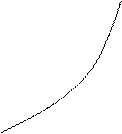


 Теплоемкость зависит от температуры в общем случае нелинейно (рис. 1 а). При определении количества теплоты для нагревания при
Теплоемкость зависит от температуры в общем случае нелинейно (рис. 1 а). При определении количества теплоты для нагревания при 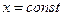 от t1 до t2 обычно применяют средние теплоемкости
от t1 до t2 обычно применяют средние теплоемкости 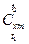 (здесь индекс «m» означает «средний»!), которые при нелинейной зависимости рассчитываются по средним табличным значениям теплоемкостей
(здесь индекс «m» означает «средний»!), которые при нелинейной зависимости рассчитываются по средним табличным значениям теплоемкостей 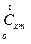 в интервале температур от 0 до t:
в интервале температур от 0 до t: 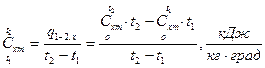 , (5)
, (5)
где 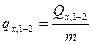 - удельная массовая теплота, кДж/кг.
- удельная массовая теплота, кДж/кг.
Следовательно
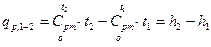 , (6)
, (6)
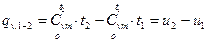 , (7)
, (7)
т.е. наиболее точно теплоту можно подсчитать как по значениям теплоемкостей, так и по значениям энтальпий h (при 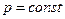 ) и внутренних энергий u (при
) и внутренних энергий u (при 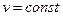 ). Значения
). Значения 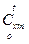 , u и h приводятся в справочной литературе в виде таблиц /2/.
, u и h приводятся в справочной литературе в виде таблиц /2/.
В пределе при уменьшении интервала температур в выражении (5) получим теплоемкость при заданной температуре t, называемую истинной теплоемкостью, Сх,ист.
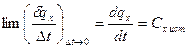 . (8)
. (8)
Со средней теплоемкостью она связана соотношением
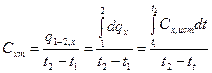 ,
, 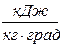 . (9)
. (9)
Для приближенных расчетов можно учесть линейную зависимость теплоемкости от температуры (рис. 1б):
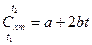 , (10)
, (10)
где a и b – индивидуальные коэффициенты (из таблиц /2/), 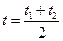 .
.
В соответствии с молекулярно-кинетической теорией внутренняя энергия газов распределяется равномерно по степеням свободы i поступательного и вращательного движения молекул. Для одноатомной молекулы i = 3 степеням свободы поступательного движения, т.е. изменяется положение молекулы в координатах x, y и z. Для двухатомных молекул к трем степеням свободы поступательного движения добавляются две степени свободы вращательного движения i = 3+2 = 5. С некоторой корректировкой для трех- и многоатомных газов число степеней свободы принимается равным i = 7.
Для идеальных газов при не очень высоких температурах на каждую степень свободы при  расходуется энергия
расходуется энергия 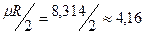 кДж/(кмоль×град). Поэтому постоянные (рис.1, в) мольные теплоемкости
кДж/(кмоль×град). Поэтому постоянные (рис.1, в) мольные теплоемкости 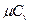 можно определить по числам степеней свободы i, а
можно определить по числам степеней свободы i, а 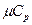 - по (i + 2) из таблицы 1.
- по (i + 2) из таблицы 1.
Таблица 1
| Атомность газов | 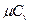 , кДж/(кмоль×град) , кДж/(кмоль×град) | 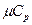 , кДж/(кмоль×град) , кДж/(кмоль×град) |
| 1 атомные | 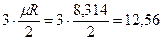 | 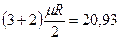 |
| 2 атомные | 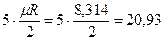 | 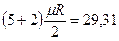 |
| 3 и многоатомные | 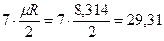 | 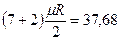 |
Для пересчета различных удельных теплоемкостей удобны соотношения:
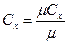 ,
, 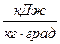 ;
; 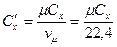 ,
, 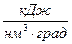 ;
;
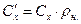 ,
, 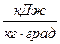 , (11)
, (11)
где 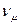 - удельный объем 1 кмоля газа при нормальных условиях,
- удельный объем 1 кмоля газа при нормальных условиях, 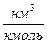 .
.
Измерение теплоемкости Срт воздуха
методом проточного калориметрирования
В лабораторном калориметре (рис. 2) к потоку газа подводится теплота от электронагревателя и измеряются все величины, необходимые для расчета теплоемкости: расход газа, количество подведенной теплоты, температуры газа на входе в калориметр и на выходе из него.
Расчетное уравнение для определения теплоемкости Срт в таком калориметре может быть получено следующим образом. Запишем уравнение первого закона термодинамики для стационарного потока газа для сечения 1 на входе и 2 на выходе:
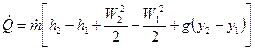 , (12)
, (12)
где 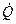 - тепловой поток – количество теплоты, подведенной от электронагревателя в единицу времени, Дж/с или Вт;
- тепловой поток – количество теплоты, подведенной от электронагревателя в единицу времени, Дж/с или Вт;
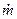 - массовый расход газа, кг/с;
- массовый расход газа, кг/с;
h – энтальпия газа, Дж/кг;
W – скорость газа, м/с;
g – ускорение свободного падения, м/с2;
y – координата сечений 1 и 2 канала по высоте, м.
В данном случае работой, затрачиваемой на изменение кинетической энергии газа 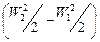 , можно пренебречь, так как скорости газа W1 и W2 мало отличаются друг от друга. Работа, затрачиваемая на изменение потенциальной энергии
, можно пренебречь, так как скорости газа W1 и W2 мало отличаются друг от друга. Работа, затрачиваемая на изменение потенциальной энергии 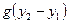 , равна нулю, поскольку калориметр расположен горизонтально
, равна нулю, поскольку калориметр расположен горизонтально 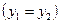 .
.
Таким образом, уравнение (12) принимает вид:
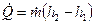 . (13)
. (13)
Проинтегрировав известное выражение для идеального газа
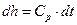 (14)
(14)
в интервале температур от t1 до t2, получим:
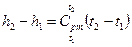 , (15)
, (15)
где 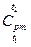 - средняя теплоемкость при
- средняя теплоемкость при 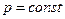 в интервале температур от t1 до t2.
в интервале температур от t1 до t2.
Из уравнений (13) и (15) следует:
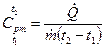 . (16)
. (16)
 2015-02-24
2015-02-24 768
768








