Стерилизация является одним из важнейших и необходимых прие-мов в микробиологической практике. Слово «стерилизация» в переводе с латинского означает обеспложивание. В практической работе под стерилизацией понимают методы, применяемые для уничтожения всех форм жизни как на поверхности, так и внутри стерилизуемых объектов. Различают термическую и холодную стерилизацию. Способы термической стерилизации: прокаливание в пламени и обжигание, сухожаровая стерилизация (горячим воздухом), стерилизация насыщенным паром под давлением (автоклавирование), дробная стерилизация (тиндализация), кипячение. Методы холодной стерилизации: стерилизация фильтрованием, газообразными средствами, ультрафиолетовыми лучами и другими видами излучений.
Возможность и целесообразность применения того или иного способа определяется в первую очередь физико-химическими свойствами материала, подлежащего стерилизации, а иногда и целью исследования.
Стерилизация питательных сред насыщенным паром под давлением (автоклавирование)
Совместное действие высокой температуры и давления пара обеспечивает особую эффективность данного способа (табл. 1).
Таблица 1
Температура насыщенного пара при разных давлениях
| Давление | Температура, °С | |
| нормальное, атм | кПа | |
| 1,0 | 101,32 | |
| 1,5 | 151,98 | |
| 2,0 | 202,65 | |
| 2,5 | 251,20 | |
| 3,0 | 299,75 |
При этом погибают и вегетативные клетки, и споры микроорганизмов. Установлено, что споры большинства микроорганизмов не выдерживают и 5-минутную экспозицию в насыщенном паре при 121 °С. Стерилизацию текучим паром под давлением осуществляют в автоклавах. Автоклав представляет собой металлический двустенный резервуар, способный выдерживать высокое давление, в который помещают стерилизуемый материал на специальную подставку. Предметы следует размещать не слишком плотно, так как пар должен проходить между ними, иначе они не нагреваются до нужной температуры и могут остаться нестерильными. По окончании времени стерилизации автоклав открывают, когда давление в нем сравняется с атмосферным. Преждевременное открывание крана автоклава недопустимо, так как перегретые среды при резком снижении давления сразу же бурно закипают, смачивают и даже иногда выталкивают ватные пробки, что нарушает впоследствии стерильность материала.
К работе с автоклавом допускаются только подготовленные лица!
Подготовка сред к стерилизации. При автоклавировании 3 - 5 % жидкости теряются в результате испарения, поэтому рекомендуется в приготавливаемые среды добавлять сверх объема примерно 5% дистиллированной воды. Тогда после стерилизации среда (раствор) будет иметь требуемую концентрацию. Среды обычно стерилизуют в пробирках, колбах, бутылях. Емкости заполняют средой не более чем на половину их высоты, чтобы предотвратить смачивание пробок. Сосуды со средами закрывают ватными пробками с бумажными колпачками. Стеклянные, резиновые, корковые и другие пробки завертывают в двойной слой оберточной бумаги и стерилизуют привязанными к склянке, закрытой ватной пробкой.
Выбор режима автоклавирования. В микробиологической практике стерилизацию в автоклавах осуществляют при температуре в пределах 111-138 °С, т.е. от 0,5 до 2,5 атм. Температура ниже 111 °С не может считаться надежной; а выше 138 0С, как правило, не является необходимой, к тому же, чем выше давление пара, тем сложнее условия эксплуатации автоклава. Микробиологи чаще всего стерилизуют среды при 0,5 и 1 атм.Температура и длительность автоклавирования питательных сред определяются, прежде всего, их составом, термоустойчивостью или термолабильностью компонентов. Такие легко разрушающиеся субстраты, как молоко или желатиновые среды, а также субстраты, содержащие сахара, витамины (пивное сусло, соки, дрожжевой автолизат и др.) обычно стерилизуют при 0,5 атм в течение 1 5 - 3 0 мин. Мясопептонные среды можно стерилизовать при 1,0 атм 20 мин. С трудом поддаются стерилизации в автоклаве различные порошки (например тальк) и вязкие жидкости (глицерин, вазелиновое масло), поэтому их лучше стерилизовать в сушильных шкафах при 160 °С в течение 2 или 1 ч при 170 °С. В этом случае слой масла или порошка в сосуде не должен превышать 1,5 см. После автоклавирования среды для проверки стерильности выдерживают 2 - 3 сут в термостате при 30 0С. Если в средах обнаруживается рост микроорганизмов, их готовят заново.
Дробная стерилизация (тиндализация) и пастеризация
Она применяется для сред, портящихся под действием температур выше 100 °С. Тиндализацию осуществляют текучим паром а автоклаве с незавинченной крышкой. Среды прогревают несколько раз по 10 - 15 мин. Между прогреваниями среды ставят в термостат при температуре 3 0°С н а 8 - 1 2 ч для прорастания жизнеспособных спор. Среды, не выдерживающие нагревания при 100 °С, прогревают более осторожно при 60 - 80°С через каждые 8 - 1 2 ч 4 - 5 дней подряд.
Таблица 2
Время, необходимое для стерилизации стеклянной посуды сухим жаром
| Температура, °С | Время, мин |
Однократный прогрев материала при температуре ниже 100°С известен под названием пастеризация. Этот метод, предложенный Пастером, предназначен для уничтожения только бесспоровых форм микроорганизмов. Следовательно, в подавляющем большинстве случаев он не обеспечивает стерильности. Пастеризацию проводят при 60-80°С 10 - 30 мин. Этот процесс используют в пищевой промышленности для обработки молока, фруктовых соков, вина, пива и др.
Стерилизация стеклянной посуды. Основным способом стерилизации стеклянной посуды является обработка ее сухим горячим воздухом при температуре не выше 180 ° в течение 1 - 3 ч (табл. 2). При этом погибают и вегетативные клетки, и споры микроорганизмов. Стерилизацию осуществляют в специальных суховоздушных (сухожаровых) стерилизаторах и сушильных шкафах, приспособленных для стерилизации и обеспечивающих автоматическое поддержание необходимой температуры.
Посуда перед стерилизацией должна быть тщательно вымыта и завернута в бумагу для сохранения стерильности после прогревания. После этого ее загружают в стерилизатор (или в сушильный шкаф) не слишком плотно, чтобы обеспечить циркуляцию воздуха и равномерный надежный прогрев стерилизуемого материала. По окончании стерилизации шкаф не открывают до тех пор, пока температура в нем не упадет до 80° С, так как при резком охлаждении иногда нарушается стерильность материала, а сильно нагретое стекло может растрескаться.
Стерилизация инструментов и приборов. Мелкие металлические инструменты - петли, иглы, пинцеты, ножницы, шпатели - стерилизуют прокаливанием в пламени (т.е. нагреванием докрасна) непосредственно перед использованием. На пламени кратковременно обжигают предметные и покровные стекла, стеклянные шпатели и палочки, фарфоровые ступки и пестики, горлышки колб, пробирок, бутылок, а также ватные пробки при посевах культур и разливе сред. В пламени погибают и вегетативные клетки, и споры микроорганизмов.
Стерилизация облучением. В микробиологической практике используют ультрафиолетовое облучение. Мощность ультрафиолета измеряется в бактах. Доза УФ-излучения, губительная для различных видов микроорганизмов (кроме спор), составляет 5 мкб/см.
1.3 УСТРОЙСТВО МИКРОСКОПА И ПРАВИЛА РАБОТЫ С НИМ
Цель работы: Изучить устройство светового биологического микроскопа и освоить правила работы с ним. Ознакомиться с различными видами микроскопии. Приобрести навыки по приготовлению фиксированных препаратов дрожжей.
Оборудование, материалы: Микроскоп; бактериологические петли; предметные стекла; спиртовка; иммерсионное масло; фильтровальная бумага; промывалка; дрожжи Sascharomyces, 96 %-ный этиловый спирт.
1.3.1 КРАТКИЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
Устройство микроскопа и правила работы с ним
Микроскоп (от греч. micros – малый и scopio – смотрю) – это оптический прибор, состоящий из трех основных частей: механической, оптической и осветительной.
Устройство микроскопа
Схема светового биологического микроскопа представлена на рис. 1.
Механическая часть или штатив состоит из ножки, основания, тубусодержателя, предметного столика, монокулярной насадки (тубуса), револьверного устройства, рукоятки грубой фокусировки (макрометрического винта), рукоятки тонкой фокусировки (микрометрического винта).
Тубус – зрительная труба микроскопа. В верхнее отверстие тубуса свободно вставляется окуляр, на нижнем конце тубуса находится вращающееся вокруг своей оси револьверное устройство (револьвер), в которое ввинчиваются объективы. Вращая револьвер, можно быстро сменить объективы во время работы с микроскопом, подводя любой объектив под тубус. Объектив должен быть центрирован, т.е. установлен на оптическую ось микроскопа. Для этого револьвер поворачивают вокруг своей оси до появления щелчка.
Предметный столик служит для размещения на нем изучаемого препарата. Препарат закрепляют на столике зажимами (клеммами). В центре предметного столика находится отверстие для прохождения лучей света и освещения препарата. В некоторых конструкциях микроскопа предметный столик может передвигаться с помощью винтов, расположенных по периферии предметного столика. Это дает возможность рассмотреть препарат в различных полях зрения.
Рукоятки грубой и тонкой фокусировки (макро- и микровинты) служат для перемещения тубуса вверх и вниз, что позволяет установить его на необходимом расстоянии от препарата. При вращении винтов по часовой стрелке тубус опускается, а при вращении против часовой стрелки – поднимается. При вращении макрометрического винта объектив ориентировочно устанавливается на фокус, т.е. на то расстояние от препарата, при котором он делается видимым. Оборот макровинта позволяет переместить тубус на 20 мм. Микрометрический винт служит для точной установки на фокус. Полный оборот его перемещает тубус на 0,1 мм. С микровинтом следует обращаться очень осторожно: допустимо вращение микровинта не более чем на 180 0С в ту или иную сторону.
Оптическая часть является наиболее ценной частью микроскопа. Она состоит из объективов и окуляра.
Окуляр (от лат. oculus – глаз) состоит их двух плосковыпуклых линз, заключенных в общую металлическую оправу. Верхняя линза – глазная (увеличивающая), нижняя – собирающая. Расстояние между линзами равно полусумме их фокусного расстояния. У окуляров с большим увеличением фокус короче, поэтому меньше и длина окуляра. Между линзами имеется диафрагма, ограничивающая поле зрения и задерживающая краевые лучи
Рис. 1 Схема устройства светового биологического микроскопа
света. Отечественные микроскопы снабжены тремя сменными окулярами, увеличение которых указано на корпусе окуляра (х7; х10; х15).
Объективы ввинчиваются в гнезда револьверного устройства и состоят из системы линз, заключенных в металлическую оправу. Передняя (фронтальная) линза объектива является самой маленькой и единственной, дающей увеличение. Остальные линзы в объективе только исправляют недостатки полученного изображения (явления сферической и хроматической аберрации) и называются коррекционными.
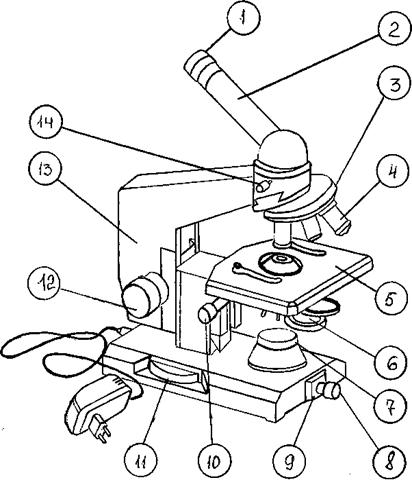 | 1 – окуляр 2 – монокулярная насадка (тубус) 3 – револьверное устройство 4 - объектив 5 – предметный столик 6 - конденсор 7 – корпус коллекторной линзы 8 – патрон с лампой 9 - шарнир 10 –рукоятка перемещения кронштейна конденсора 11– рукоятка тонкой фокусировки (микрометрический винт) 12 – рукоятка грубой фокусировки (макрометрический винт) 13 - тубусодержатель 14 – винт для крепления насадки |
В гнезда револьверного устройства ввинчиваются четыре объектива, увеличение которых указано на корпусе объектива (х8; х20; х40; х90 или 100). Каждый объектив характеризуется своим фокусным расстоянием (расстоянием между предметным стеклом и фронтальной линзой): объектив х8 имеет фокусное расстояние около 9 мм, объектив х40 – 0,65 мм, объектив х90 – 0,15 мм.
Объективы подразделяются на сухие и иммерсионные.
При работе с сухими объективами (х8, х20, х40) между фронтальной линзой и препаратом находится воздух. В этом случае лучи света проходят среды с различными показателями преломления (покровное стекло, воздух), часть их отклоняется и не попадает в объектив.
При работе с иммерсионными объективами (х90 или х100) для устранения светорассеяния расстояние между фронтальной линзой объектива и препаратом заполняют иммерсионным (кедровым) маслом, показатель преломления лучей света которого близок к показателю преломления лучей света, проходящего через стекло.
Общее увеличение микроскопа определяется как произведение увеличения объектива на увеличение окуляра. Например, если в работе используют окуляр х15, а под тубусом находится объектив х90, то увеличение рассматриваемого с помощью микроскопа объекта составит х1350.
Осветительная часть микроскопа состоит из двухлинзового конденсора, ирис-диафрагмы и патрона с низковольтной лампочкой накаливания, питающейся через понижающий трансформатор от сети напряжения 120…220 В.
Конденсор служит для лучшего освещения препарата. Он собирает световые лучи в пучок и направляет их через отверстие предметного столика на препарат. С помощью рукоятки для перемещения кронштейна конденсора его можно перемещать вверх и вниз, благодаря чему меняется угол сходимости лучей и, следовательно, степень освещения объекта. Чем выше положение конденсора, тем лучше освещен препарат.
Ирис-диафрагма располагается под конденсором и служит для регулировки потока света, поступающего в конденсор. Она состоит из металлических серповидных пластинок. Расширить или сузить отверстие диафрагмы можно с помощью специального рычажка. При вращении его по часовой стрелке отверстие ирис-диафрагмы увеличивается и, следовательно, увеличивается степень освещения объекта.
При работе с иммерсионными объективами степень освещения препарата должна быть максимальной, поэтому шторку ирис-диафрагмы открывают, а конденсор поднимают в крайнее верхнее положение.
При работе с сухими объективами, как правило, рассматривают неокрашенные объекты. Для достижения контрастности конденсор опускают вниз, а отверстие ирис-диафрагмы уменьшают.
Правила работы с микроскопом
1. На рабочем столе микроскоп ставят тубусодержателем к себе на расстоянии 3…5 см от края стола;
2. Включают микроскоп в сеть и устанавливают правильное освещение (см. раздел 2.1.1);
3. На предметный столик помещают исследуемый препарат и закрепляют его клеммами;
4. Под тубус помещают нужный объектив и с помощью макро и микровинтов устанавливают фокусное расстояние. Так, при работе с иммерсионными объективами на препарат предварительно наносят каплю иммерсионного масла и осторожно опускают тубусодержатель макровинтом до соприкосновения со стеклом. Затем, внимательно смотря в окуляр, очень медленно поднимают тубусодержатель, вращая его против часовой стрелки, до тех пор, пока не увидят изображение. Точную наводку объектива на фокус производят микрометрическим винтом. При работе с сухими объективами препарат вначале рассматривают с объективом х8. Поднимая с помощью макровинта тубусодержатель и внимательно смотря в окуляр, устанавливают фокусное расстояние (около 9 мм) и добиваются четкости изображения, используя микрометрический винт. Далее, двигая предметный столик или предметное стекло, устанавливают в центр поля тот участок препарата, в котором лучше всего виден изучаемый объект. Затем, вращая револьверное устройство вокруг своей оси, под тубус помещают объектив на х20 или х40. При этом под тубус не должен попасть объектив х90. В револьверном устройстве объективы располагаются таким образом, что если найдено изображение с объективом х8, то при рассмотрении препарата с объективами большего увеличения нужно слегка подрегулировать четкость изображения с помощью макро- и микрометрических винтов;
5. Во время микроскопирования необходимо держать оба глаза открытыми и пользоваться ими попеременно;
6. После окончания работы следует убрать препарат с предметного столика, опустить вниз конденсор, поставить под тубус объектив х8, удалить мягкой тканью или марлей, смоченной в спирте, иммерсионное масло с фронтальной линзы объектива х90, под объектив положить марлевую салфетку, опустить тубусодержатель.
1.4 Техника отбора чистых культур микроорганизмов
Отбор проб чистых культур бактерий и дрожжей, которые вырастают на поверхности плотной среды в виде мазеобразного налета или в жидкой среде ведут в следующей последовательности:
1. Зажигают спиртовку.
2. Пробирку с культурой помещают в левую руку между большим и указательным пальцами в наклонном положении. Поверхность с налетом микроорганизмов должна быть обращена вверх и хорошо видна.
3. Петлю держат вертикально в пламени горелки и прокаливают докрасна, затем наклоняют и обжигают примыкающую к ней часть петледержателя.
4. Мизинцем и безымянным пальцем правой руки прижимают к ладони наружную часть ватной пробки, вынимают ее из пробирки и держа в таком положении, не касаясь окружающих предметов.
5. Края открытой пробки обжигают в пламени горелки.
6. Осторожно вводят стерильную петлю в пробирку с культурой и охлаждают ее о стенки пробирки или прикоснувшись к питательной среде, свободной от микроорганизмов. Немного отстранив пробирку с культурой от пламени горелки, легким движением осторожно отбирают небольшое количество микробной массы с поверхности среды или каплю жидкости с клетками. Вынимая петлю из пробирки, следят за тем, чтобы отобранный материал не касался стенок и петля не оказалась над пламенем горелки.
7. Снова обжигают в пламени горелки край пробирки, затем, легким круговым движением, обжигают ватно-марлевую пробку и закрывают пробирку.
8. Пробирку с культурой ставят в штатив, а извлеченный материал используют для приготовления препарата.
9. Клетки микроорганизмов, оставшиеся не петле, сжигают в пламени горелки.
Отбор чистых культур микроскопических грибов ведут с использованием препаровальной иглы в той же последовательности, что и отбор одноклеточных организмов. Из пробирки отбирают кусочек мицелия, слегка погружая иглу в питательную среду таким образом, чтобы не нарушить структуру мицелия.
1.5 Приготовление препаратов фиксированных клеток
Фиксированными считают клетки микроорганизмов, в которых прерваны жизненные процессы, но полностью сохранена тонкая структура.
Для получения фиксированных препаратов важно правильно подготовить предметные стекла. Они должны быть чистыми и тщательно обезжиренными. Для этого стекла, бывшие в употреблении, выдерживают 1-2 часа в хромовой смеси (в 1 л воды вносят 50 г бихромата калия и 100 г технической серной кислоты), после чего ополаскивают теплой водой и спиртом. Можно также кипятить стекла в течение 15 мин. в растворе соды или мыльной воды. Для проверки чистоты стекла на его поверхность наносят каплю воды. При достаточном обезжиривании капля растекается равномерно и не собирается в выпуклые, медленно высыхающие пузырьки. Берут стекла пинцетом или аккуратно за грани, так как пальцы оставляют на поверхности жирные пятна.
Приготовление фиксированных препаратов ведут в следующей последовательности:
1. На середину чистого обезжиренного предметного стекла стерильной петлей наносят небольшую каплю воды. В нее вносят исследуемый материал, отобранный по методике, описанной в разделе 2.2.1. Полученную суспензию равномерно распределяют по поверхности стекла тонким слоем таким образом, чтобы препарат распределился на площади примерно 2…3 см2.
2. Полученный мазок высушивают при комнатной температуре на воздухе.
3. Производят фиксацию мазка. Для этого стекло с высохшим мазком проводят 3-4 раза над пламенем горелки той стороной, где мазок отсутствует. Цель фиксации:
- умертвить клетки микроорганизмов и сделать их безопасными (что особенно важно при работе с патогенными микроорганизмами);
- зафиксировать (закрепить) мазок на стекле (чтобы они не смывались при окрашивании);
- улучшить окрашивание, поскольку мертвые клетки лучше адсорбируют на своей поверхности различные красители.
Приготовление фиксированных препаратов из естественных мест обитания микроорганизмов проводится так же, как и из чистых культур.
Помимо термической обработки, применяют также фиксацию химическими веществами: погружают предметное стекло с мазком в мензурку с 96 %-ным этанолом на 15-20 мин, с ацетоном на 5 мин, со смесью 96 % -ного этанола и 40%-ного формалина (соотношение 95:5) на 2 мин. и др.
На 1 объем жидких дрожжей взять 3-5 объемов воды. Смесь энергично взболтать и оставить на 1 мин.
Из верхнего слоя дрожжевой жидкости стеклянной палочкой перенести небольшую каплю на предметное стекло, добавить 1 каплю раствора Люголя. Накрыть покровным стеклом и слегка прижать его сухим концом стеклянной палочки для удаления пузырьков воздуха. Препараты рассмотреть под микроскопом при увеличении в 500—1000 раз (объективы Х40 и Х90).
4.Написать отчет о проделанной работе.
Микроскопирование препаратов дрожжей позволяет следить за их состоянием и размножением. Молодые и зрелые дрожжи крупнее состарившихся. Оболочка у них едва заметна, вакуоли отсутствуют или очень малы. Они имеют большое количество почкующихся клеток. О старении культуры дрожжей можно судить по следующим признакам: их оболочка имеет вид утолщенного ободка, строение цитоплазмы зернистое, присутствуют капельки жира.
1.6.1 Оформление и анализ результатов исследований
В отчете студенты должны кратко законспектировать теоретических материал. Наблюдаемые под микроскопом картины нужно зарисовать. Под рисунками необходимо указать увеличение и подписать название изучаемого объекта.
Контрольные вопросы
1. Каково устройство биологического микроскопа?
2. Из каких частей и механизмов состоит механическая часть микроскопа?
3. Назовите основные характеристики микроскопа.
4. Что понимают под разрешающей способностью микроскопа? Как она определяется?
5. Что составляет оптическую систему микроскопа?
6. Объективы бывают сухие и иммерсионные. Что это значит?
7. Как определяется общее увеличение микроскопа?
8. Что входит в состав осветительной системы микроскопа?
9. Как следует настроить осветительную систему при работе с иммерсионным объективом?
10. Какие существуют правила работы с микроскопом?
11. Чем определяется четкость получаемого изображения?
12. Перечислить основные правила работы с микроскопом.
13. Как проводится отбор проб чистой культуры микроорганизма?
14. Перечислите основные этапы приготовления фиксированного окрашенного препарата.
ЛАБОРАТОРНАЯ РАБОТА № 2
ИЗУЧЕНИЕ МОРФОЛОГИИ БАКТЕРИЙ. СЛОЖНЫЕ И
ДИФФЕРЕНЦИАЛЬНЫЕ МЕТОДЫ ОКРАСКИ БАКТЕРИЙ
Цель работы: Ознакомиться с морфологическим разнообразием бактерий и основными признаками, используемыми при их идентификации. Изучить различные сложные и дифференциальные методы окраски бактерий и их структур и разобраться в сущности этих методов и цели их использования. Освоить технику окраски бактерий по Граму и спор бактерий по Шефферу-Фултону.
Оборудование, материалы: Микроскоп; бактериологические петли; предметные стекла; спиртовка; иммерсионное масло; фильтровальная бумага; набор красок для окраски по Граму (фильтровальные бумажки с генцианвиолетом, растворы Люголя и фуксина рабочего) и окраски спор по Шефферу-Фултону (растворы бриллиантовой зелени и сафранина); 96 %-ный этиловый спирт: лоток с рельсами для предметных стекол; промывалка; чистые культуры бактерий: Staphylococcus albus; Sarsina flava; Escherichia coli; Bacillus subtilis.
2.1 КРАТКИЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
2.1.1 Основные признаки, используемые при идентификации
микроорганизмов
Определение систематической принадлежности микроорганизмов – сложная задача, требующая длительных наблюдений, значительного количества специфических исследований и биохимических анализов.
При идентификации микроорганизмов учитывают:
- морфолого-цитологические признаки. К ним относятся строение, форма и размеры клеток, их взаимное расположение, тинкториальные свойства (особенности при окрашивании различными красителями), способность к образованию спор и капсул, подвижность, наличие жгутиков, образование в клетках некоторых включений, особенности размножения;
- физиолого-биохимические признаки. При изучении физиолого-биохимических признаков устанавливают отношение микроорганизмов к различным источникам углерода и азота, потребность в кислороде, температурные границы роста, солеустойчивость, чувствительность к антибиотикам, ферментативные тесты;
- культуральные признаки. К таким признакам относятся особенности роста микроорганизмов на плотных и жидких питательных средах.
При идентификации бактерий рекомендуется также учитывать дополнительные признаки: серологические свойства, фагоустойчивость, химический состав клеточных стенок, содержание отдельных нуклеотидов в нуклеоиде (единственной хромосоме бактерий – молекуле ДНК, состоящей из двух спирально закрученных цепочек нуклеотидов, замкнутых в кольцо).
Чем больше у различных микроорганизмов общих признаков, тем ближе они находятся друг к другу по степени родства.
Основными признаками, позволяющими распределить микроорганизмы на группы, являются морфологические признаки, которые легко и достаточно быстро можно определить с помощью микроскопа.
2.1.2 Морфологические признаки бактерий
Бактерии объединяют обширную группу в основном одноклеточных микроорганизмов, разнообразную по форме, размерам и обмену веществ. Они являются прокариотными микроорганизмами.
При дифференциации бактерий путем микроскопии учитывают размеры и формы клеток, их взаимное расположение, химический состав и строение клеточных стенок, способность образовывать споры и капсулы, подвижность.
Основными формами бактерий, которые присутствуют в пищевом сырье, а также в продуктах растительного и животного происхождения, являются сферические бактерии (кокки) и палочковидные бактерии (палочки).
К основным морфологическим признакам кокков относятся их размеры (диаметр кокков в среднем составляет 1…2 мкм) и взаимное расположение. Взаимное расположение кокков определяется направлением образования перегородок при делении клеток. Если после деления клетки расходятся и располагаются поодиночке, то такие формы называются монококками или микрококками. Если при делении образуются скопления, напоминающие виноградные грозди, их относят к стафилококкам. Кокки, остающиеся после деления в одной плоскости связанными парами, называются диплококками, а образующие разной длины цепочки – стрептококками. Сочетания из четырех кокков, появляющиеся после деления клетки в двух взаимно перпендикулярных плоскостях представляют собой тетракокки. Если кокки делятся в трех взаимно перпендикулярных плоскостях, то они образуют скопления кубической формы - сарцины. Как выглядят различные скопления кокков под микроскопом изображено на рис. 2.
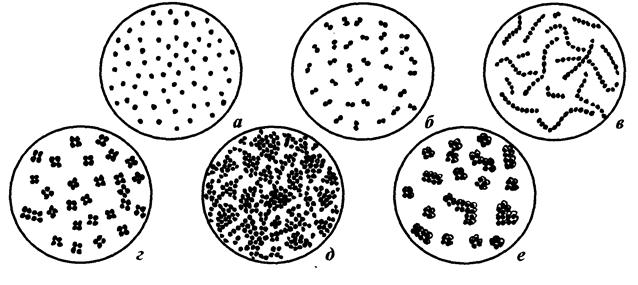
Рис. 2 Взаимные расположения кокков: а - микрококки; б - диплококки;
в - стрептококки; г - тетракокки; д - стафилококки; е - сарцины
Основными морфологическими признаками палочковидных бактерий, которые определяются путем микроскопии,являются размеры палочек (средняя длина палочек – 2…7 мкм, диаметр в поперечнике - 0,5…1 мкм), взаимное расположение клеток, способность образовывать споры, подвижность.
Палочковидные бактерии могут располагаться поодиночке, попарно (диплобактерии) и цепочками (стрептобактерии).
При микроскопии легко можно определить спорообразующие и не спорообразующие формы палочковидных бактерий. Вегетативные клетки хорошо адсорбируют красители на своей поверхности и полностью окрашиваются. Оболочка споры малопроницаема, краски в них почти не проникают и под микроскопом споры имеют вид округлых или овальных блестящих зерен. Палочки, образующие споры называются бациллами и клостридиями. У бацилл размер споры не превышает ширину клетки и поэтому при образовании споры форма клетки не меняется. У клостридий диаметр споры больше толщины клетки и поэтому при созревании споры клетка приобретает форму веретена (если спора располагается в центре клетки) или барабанной палочки (если спора располагается на одном из полюсов клетки). На рис. 3 представлены морфологические разновидности палочковидных бактерий.
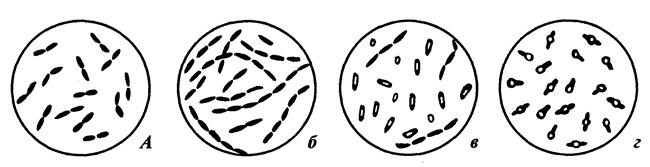
Рис. 3 Морфология палочковидных бактерий: а - диплобактерии;
б - стрептобактерии; в - бациллы; г - клостридии
При идентификации палочек диагностическое значение имеют также расположение спор в клетках бацилл и клостридий, наличие и расположение жгутиков, способность образовывать капсулы.
2.1.3 Сложные и дифференциальные методы окраски бактерий
Различают простые, сложные и дифференциальные методы окраски бактерий. При простой окраске используют один краситель и прокрашивают всю клетку. Сложное окрашивание предусматривает применение двух или нескольких красителей (например, при определении отношения бактерий к окраске по Граму). Дифференциальное окрашивание основано на индивидуальном отношении биологических структур клетки к различным красителям (окраска спор, оболочки, капсул, метахроматина и др.). При этом так же, как и в сложных методах, как правило, используется несколько красителей.
Сложные методы окраски позволяют распределить бактерии на группы, что имеет важное диагностическое значение при их идентификации. Среди сложных методов наиболее широкое применение нашел метод окраски бактерий по Граму, позволяющий разделить бактерии в зависимости от химического состава и структуры клеточной стенки на две основные группы - грамположительные (грам+; Г+) и грамотрицательные (грам-; Г-). Грамположительные бактерии по этому методу окрашиваются в сине-фиолетовый цвет, а грамотрицательные – в розовый. К сложным методам относится и метод окраски по Цилю-Нильсену, позволяющий дифференцировать бактерии на две группы по кислотоустойчивости. Этот метод позволяет выявить туберкулезную палочку, бактерии паратуберкулезного энтерита крупного рогатого скота и другие кислотоустойчивые микроорганизмы.
При использовании дифференциальных (специальных) методов можно окрасить споры, определить наличие в клетках запасных питательных веществ, выявить клеточные структуры.
При окраске спор, например, можно использовать различные методы (методы Шеффера-Фултона, Пешкова, Златогорова, Меллера и др.), основанные на разрыхлении малопроницаемой для красителей оболочки спор различными способами (путем нагревания, обработки препарата кислотами, щелочами) с одновременным или дальнейшим их окрашиванием концентрированным красителем. После такой обработки препарат промывают водой (при этом клетки обесцвечиваются, а споры остаются окрашенными) и докрашивают вегетативные клетки красителем контрастного цвета.
С другими специальными методами, позволяющими определить наличие и содержание запасных веществ в клетках (определение гликогена и волютина), можно будет ознакомиться при исследовании качества производственных дрожжей (лабораторная работа № 7).
На занятии студенты знакомятся с основными признаками, которые учитываются при идентификации микроорганизмов, обращают внимание на морфологические признаки кокков и палочек, диагностическое значение сложных и дифференциальных методов окраски бактерий. Осваивают технику окраски бактерий по методу Грама. Определяют, какие из представленных для исследования бактерии относятся к грамположительным, а какие к грамотрицательным. Готовят фиксированный мазок из чистой культуры спорообразующих бактерий Bacillus subtilis и окрашивают его по Шефферу-Фултону.
2.2.1 Окраска бактерий по методу Грама
Сущность метода заключается в различии химического состава и строения клеточной стенки грамположительных и грамотрицательных бактерий.
Клеточная стенка грам+ бактерий толстая, но однослойная, содержит много пептидогликана – муреина, а также тейховые кислоты, которые образуют прочное соединение с красителями - генцианвиолетом и йодом и поэтому остаются окрашенными после обработки мазка спиртом. Таким образом, грам+ бактерии по методу Грама окрашиваются в сине-фиолетовый цвет.
У грам - бактерий клеточная стенка тонкая, но двухслойная. Муреина мало, причем он содержится во внутреннем слое клеточной стенки, тейхоевые кислоты отсутствуют. Внешний слой клеточной стенки содержит, главным образом, вещества, обладающие гидрофобными свойствами – липополисахариды и липопротеиды. Эти вещества не образуют прочного комплекса с красками генцианвиолетом и йодом и поэтому клетки обесцвечиваются после обработки 96 %-ным этиловым спиртом и после дополнительной окраски красителем фуксином окрашиваются в бледно-розовый цвет.
Техника окраски по Граму
1. На предметном стекле готовят фиксированный мазок исследуемой чистой культуры;
2. Мазок окрашивают красителем генцианвиолетом через полоску фильтровальной бумаги. Можно также использовать заранее приготовленные фильтровальные бумажки, смоченные 1 %-ным спиртовым раствором кристаллвиолета и высушенные (метод Грама в модификации А.В. Синева). В этом случае бумажки помещают на фиксированный мазок и смачивают несколькими каплями воды. Окраску препарата проводят в течение 2…3 мин;
3. Фильтровальную бумагу снимают с мазка, краску сливают и наносят на мазок раствор Люголя на 2 мин;
4. Раствор Люголя сливают с мазка и обрабатывают 96 %-нам спиртом в течение 30…60 сек. Затем препарат промывают водой и подсушивают фильтровальной бумагой;
5. Мазок окрашивают красителем фуксином 2…3 мин, второй раз промывают водой и подсушивают фильтровальной бумагой.
Затем на стекло наносят каплю иммерсионного масла и рассматривают препарат с объективом х90 или х100 при максимальном освещении.
2.2.2 Окраска спор бактерий по Шефферу-Фултону
Сущность метода заключается в комбинированном действии концентрированного раствора красителя бриллиантового зеленого и температуры на малопроницаемую оболочку спор с дальнейшим обесцвечиванием цитоплазмы вегетативной клетки и ее контрастным докрашиванием сафранином. Таким образом, споры окрашиваются в зеленый цвет, а клетки – в красный.
Техника окраски по Шефферу-Фултону
1. На краю предметного стекла (на расстоянии примерно 1,5-2,0 см от края) готовят густой нефиксированный мазок из чистой культуры спорообразующих бактерий;
2. На раствор наносят водный раствор бриллиантовой зелени, и мазок с краской нагревают над пламенем горелки до появления пара. Нельзя допускать прикипания краски к мазку. Поэтому препарат периодически отстраняют от пламени. Нагревание мазка с краской проводят в течение 3 мин;
3. Краску сливают, препарат быстро промывают водой и просушивают фильтровальной бумагой;
4. Окрашивают мазок раствором сафранина 2…3 мин, затем краску сливают, мазок вторично промывают водой и подсушивают фильтровальной бумагой.
Далее на мазок наносят каплю иммерсионного масла и рассматривают под объективом на х90 или х100 при максимальном освещении.
Оформление и анализ результатов исследований
В отчете студенты кратко конспектируют теоретический материал и переписывают сущность и технику окраски бактерий по Граму и спор бактерий по Шефферу-Фултону. Зарисовывают микроскопические картины исследованных чистых культур бактерий с учетом морфологических особенностей каждого микроорганизма. Под каждым рисунком подписывают латинское название микроорганизма, отношение его к окраске по Граму, увеличение исследованного объекта.
Контрольные вопросы
1. Какие признаки учитывают при идентификации микроорганизмов. Какие признаки являются основными при дифференциации бактерий?
2. Как провести дифференциацию кокковых форм бактерий по их взаимному расположению?
3. Каким образом можно провести дифференциацию палочковидных бактерий по их внешнему виду?
4. Каково назначение сложных методов окраски бактерий? Какие сложные методы окраски бактерий Вам известны?
5. Для чего используются дифференциальные (специальные) методы окраски бактерий? Привести примеры.
6. В чем заключается сущность метода окраски бактерий по Граму?
7. Каким образом проводят окрашивание фиксированных препаратов бактерий по методу Грама?
8. В чем заключается сущность метода окрашивания бактериальных спор по Шефферу-Фултону?
9. Какова техника окраски спор бактерий по методу Шеффера-Фултона?
10.Какими методами можно выявить капсулы у бактерий? Как осуществляют окраску капсул по Бурри-Гинсу?
 2015-02-24
2015-02-24 16271
16271
