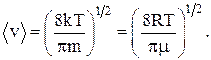
Относительная скорость применяется для расчета числа молекул, движущихся со скоростями в интервале от v до v + dv:
u = v/vв.
Закон распределения молекул идеального газа по скоростям в стационарном состоянии (распределение Максвелла):
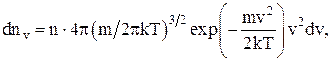
где dnv – среднее число молекул в единице объема со скоростями в интервале от v до v + dv;
n – число молекул в единице объема.
Функция распределения (доля молекул от их общего числа отнесена к некоторому интервалу скоростей):
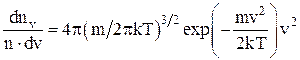
или
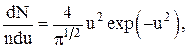
где dnv/ndv – функция распределения.
Свободные пробеги молекул – прямолинейные участки траектории, проходимые молекулой между двумя последовательными соударениями.
Средняя длина свободного пробега молекулы – среднее расстояние, проходимое молекулой между двумя соударениями:
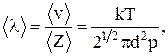
где Z – число соударений;
<v> – средняя скорость молекулы;
k – постоянная Больцмана;
<d> – диаметр молекулы;
p – давление;
Среднее число соударений <z> – число соударений молекул, численно равное отношению средней скорости движения молекул <v> к средней длине свободного пробега:
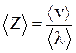 , или
, или 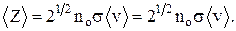
Эффективный диаметр молекулы d – минимальное расстояние, на которое сближаются при столкновении центры 2–х молекул.
Эффективное сечение – величина равная
s = pd2.
Барометрическая формула показывает, что давление убывает с высотой тем быстрее, чем тяжелее газ и чем ниже его температура:
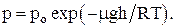
Закон распределения молекул газа по высоте в поле сил тяготения (распределение Больцмана):
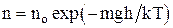 ,
, 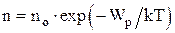 ,
,
где no – число молекул в единице объема в том месте, где потенциальная энергия молекул равна нулю;
n – число молекул в единице объема в тех точках пространства, где потенциальная энергия молекул равна Wp.
Распределение Максвелла–Больцмана – благодаря этому распределению можно определить долю молекул идеального газа, имеющих скорости в интервале от v до v + dv и обладающих потенциалом c = gh во внешнем силовом поле:
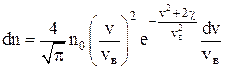 ,
,
где vв – наиболее вероятная скорость, значению которой соответствует максимум кривой Максвелла.
Зависимость плотности газа от высоты:
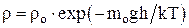 ;
; 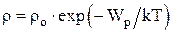 ,
,
где mo – масса одной молекулы.
 2015-02-27
2015-02-27 2730
2730
