Электроды (полуэлементы) в зависимости от типа электродных реакций подразделяют на электроды первого и второго рода и окислительно-восстановительные (резокс-электроды). Электроды первого рода представляют собой металлические или газовые электроды, которые находятся в равновесии с соответствующими ионами в растворе, например цинковый электрод (цинк, погруженный в сульфат цинка), медный электрод (медь в растворе сульфата меди). Потенциалы этих электродов зависят лишь от активности (концентрации) в растворе ионов цинка или меди. К электродам первого рода относятся также газовые электроды, которые состоят из металлического проводника, контактирующего одновременно с газом, который пропускают через раствор, и с раствором, содержащим ионы этого газа (или ионы, образующиеся при взаимодействии газа с молекулами растворителя). Металлический электрод должен быть химически инертным относительно раствора и всех остальных составляющих электрохимической системы, чтобы исключить побочные электродные процессы. Очень часто таким металлом является платина. К газовым электродам относятся кислородный, хлорный, водородный электроды. Электроды второго рода – это металлические электроды, на которые нанесен слой их труднорастворимых соединений (соли, оксиды или гидроксиды, погруженные в электролит, который содержит такой же анион, как и труднорастворимые соединения).
Эти электроды обратимы по отношению к указанным анионам, т.е. находятся с ними в термодинамическом равновесии. Схематично такой электрод можно записать так: 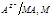 . величина потенциала электрода второго рода зависит только от концентрации анионов труднорастворимого соединения в растворе.
. величина потенциала электрода второго рода зависит только от концентрации анионов труднорастворимого соединения в растворе.
Величины потенциалов электродов второго рода сохраняются постоянными, хорошо воспроизводимы, и поэтому эти электроды используют в качестве стандартных электродов сравнения при измерении электродных потенциалов. Наиболее широко известны электроды второго рода – каломельный, хлор-серебрянный и ртутно-сульфатный.
окислительно-восстановительными электродами электроды, на которых происходят окислительно-восстановительные реакции, не сопровождающиеся фазовыми переходами. Металл в редокс-электроде не принимает участия в электродной реакции, а выполняет лишь функцию переносчика электронов (как и в газовых электродах).
Различают простые редокс-электроды, на которых происходит реакция, приводящая только к изменению заряда ионов. В реакциях на сложных редокс-электродах обычно принимают участие ионы водорода, ионы OH- или молекулы воды.
Величина окислительно-восстановительного потенциала является мерой восстановительной или окислительной способности раствора. Чем сильнее восстановительные свойства раствора, тем более отрицательный потенциал приобретает электрод, и наоборот.
 2015-02-04
2015-02-04 2916
2916








