В ходе любой реакции изменяется количество участвующих в ней веществ. Изменение количества какого-либо реагента за определенное время характеризует скорость химической реакции.
Скорость реакции – это изменение концентрации реагирующих веществ во времени. При постоянном объеме системе она численно равна изменению концентрации одного из реагирующих веществ в единицу времени:
υ = ± 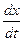
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры, энергии активации, действия катализаторов. Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ:
υ = kс,где
V – скорость реакции; k – константа скорости реакции.
Константа скорости химической реакции численно равна скорости данной реакции в случае равенства единице концентраций всех исходных веществ. Константа скорости не зависит от концентрации реагирующих веществ и времени.
|
|
|
Для элементарных реакций справедлив закон действующих масс, согласно которому скорость реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равным стехиометрическим коэффициентам.
Зависимость скорости реакции от температуры выражается правилом Вант–Гоффа, по которому повышение температуры на 10° вызывает увеличение скорости реакции примерно в 2-4 раза, то есть температурный коэффициент скорости реакции γ равен отношению констант скорости kt+10 и kt:
γ = 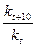
Более точная зависимость дается уравнением Аррениуса:
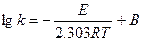
где Е – энергия активации: В – постоянная, характерная для данной реакции
Энергия активации – разница между среднейэнергией реагирующих молекул и той энергией, которойдолжны достигнуть, чтобы столкновение было эффективным. Чем больше энергия активации, тем медленнее протекает реакция.
В химической кинетике реакции делятся на реакции первого порядка, реакции второго порядка и реакции третьего порядка.
Зависимость скорости реакции от концентрации выражается законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам при формулах этих веществ в уравнении реакции. Эту зависимость для реакции, протекающей по схеме
аА + bВ = сС + dD,
где А,В,С, D – вступающие в реакцию и образующиеся вещества.
а,с,b,d – коэффициенты, показывающие в каких молярных количествах
вступают во взаимодействие и образуются вещества, можно выразить уравнением
|
|
|
υ = k·[А]а ·[В]b,
где υ – скорость реакции, моль/л·сек; k– константа скорости; [А] и [В] – молярные концентрации реагирующих веществ, моль/л.
Константа скорости химической реакции не зависит от концентрации реагирующих веществ, а определяется природой реагирующих веществ и условием протекания реакции (t0, каt, Р).
Для конкретной реакции, протекающей при данных условиях, константа скорости есть величина постоянная.
При написании выражения скорости химической реакции в гетерогенной (неоднородной) системе учитываются концентрации только газообразных веществ, а также площадь поверхности раздела между фазами.
 2015-02-04
2015-02-04 515
515








