Спектры поглощения в видимой и ультрафиолетовой областях обусловлены переходами молекулы из основного в возбуждённые электронные состояния. Изучение электронных спектров поглощения позволяет получить важные сведения об электронном строении и различных свойствах молекул. При поглощении света, молекула переходит из основного состояния с энергией 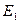 в возбуждённое состояние, с энергией
в возбуждённое состояние, с энергией 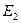 . Частота поглощаемого излучения связана с разностью энергий
. Частота поглощаемого излучения связана с разностью энергий 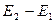 соотношением вида:
соотношением вида:
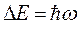
поскольку:
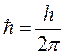
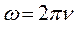
будем иметь соответственно:
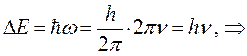
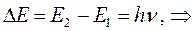
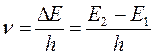
учитывая, что:
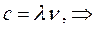
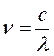
а также связь между длиной волны 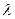 и волновыми числами
и волновыми числами 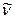 :
:
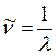
нетрудно установить связь частот 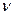 , длин волн
, длин волн 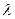 и волновых чисел
и волновых чисел 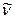 . Так, как было установлено выше:
. Так, как было установлено выше:
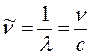
откуда следует, что:
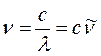
или после подстановки в выражение вида:
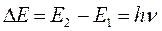
будем иметь соответственно:
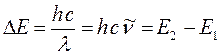
Величина 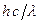 (или
(или 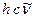 ) представляет собой энергию света с длиной волны
) представляет собой энергию света с длиной волны 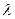 , поглощаемую одной молекулой. Умножая её на число Авогадро
, поглощаемую одной молекулой. Умножая её на число Авогадро 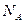 , получаем количество энергии, пересчитанное на 1 моль вещества. Длину волны
, получаем количество энергии, пересчитанное на 1 моль вещества. Длину волны 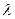 в видимой или УФ – спектроскопии обычно выражают либо в ангстремах (Å), либо в нанометрах (нм), здесь 1 нм = 10-9 м = 10Å. Волновые числа выражают обычно в обратных сантиметрах (см-1). Волновое число
в видимой или УФ – спектроскопии обычно выражают либо в ангстремах (Å), либо в нанометрах (нм), здесь 1 нм = 10-9 м = 10Å. Волновые числа выражают обычно в обратных сантиметрах (см-1). Волновое число 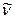 равно количеству волн, приходящихся на 1 см; чем больше длина волны, тем меньшее количество волн укладывается на длине в 1 см, т.е. тем меньше волновое число. Взаимосвязь между длиной волны, частотой и волновым числом может быть установлена на основании соотношения вида:
равно количеству волн, приходящихся на 1 см; чем больше длина волны, тем меньшее количество волн укладывается на длине в 1 см, т.е. тем меньше волновое число. Взаимосвязь между длиной волны, частотой и волновым числом может быть установлена на основании соотношения вида:
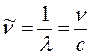
Так, когда волна сталкивается с молекулой, она может либо рассеиваться, либо поглощаться, передаваясь молекуле. Относительная вероятность протекания того или иного процесса является свойством той молекулы, с которой произошло столкновение. Если произошло поглощение электромагнитной энергии света, о молекуле говорят, что она возбуждена или перешла в возбужденное состояние. Молекула или часть молекулы, которая может быть возбуждена посредством поглощения света в видимой и ближней УФ – области, называется хромофором.
УФ – область является коротковолновой областью спектра, с одной стороны примыкающей к видимой её части, а с другой переходящей на рентгеновский спектр. Весь УФ – спектр делят на ближний, с длиной волны 400-300 нм, который примыкает к видимой (400-800 нм), дальней (300-200 нм) и вакуумной (200-50 нм) УФ – областям. Предметом изучения абсорбционная УФ – спектроскопии является изучение электронных спектров поглощения. Так, поглощение энергии происходит с наибольшей вероятностью только в том случае, если количество поглощённой энергии соответствует разности энергий в соответствующих квантованных состояниях, в которых может находиться рассматриваемая система. Поскольку:
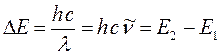
имеем соответственно:
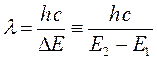
Таким образом, свет с длиной волны l поглощается только тогда, когда:
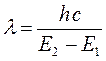
где 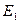 - энергетический уровень молекулы до поглощения, а
- энергетический уровень молекулы до поглощения, а 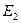 - энергетический уровень, достигаемый в результате поглощения. Упрощённо переход между электронными энергетическими уровнями соответствует энергии, необходимой для перемещения электрона с одной молекулярной орбитали на другую. Зависимость вероятности поглощения от длины волны называется спектром поглощения. Задача абсорбционной спектроскопии состоит в накоплении и анализе данных по поглощению. Таким образом, поглощение световой энергии в видимой и УФ – областях, связаны с различным типом электронных переходов. Оптические спектры атомов связаны с квантовыми переходами электронов внешней электронной оболочки. При объединении атомов в молекулу обобществлённые (валентные) электроны образуют внешнюю оболочку и остаются ответственными за оптические спектры. Как показали расчёты, при образовании молекул, имеет место расщепление энергетических уровней. При этом образуются молекулярные орбитали трёх типов – связывающие, разрыхляющие и несвязывающие. Объяснение этому можно дать только с позиций метода молекулярных орбиталей, который позволяет наиболее корректно вскрыть суть данного явления. Так, с точки зрения метода молекулярных орбиталей, молекула рассматривается как единая система ядер и электронов. Волновая функция такой системы будет задаваться как линейная комбинация соответствующих атомных орбиталей. Такой подход получил название метода линейных комбинаций атомных орбиталей (ЛКАО – МО). С позиций данного метода, для образования устойчивой молекулярной орбитали необходимо, чтобы энергии исходных атомных орбиталей были близки друг к другу. При этом последние не должны сильно отличаться по свойствам симметрии. Орбитальные коэффициенты, входящие в выражение полученной таким образом молекулярной волновой функции, будут очевидно определять вклад каждой из комбинируемых базисных волновых функций в образование молекулярной орбитали. Если указанные выше условия образования молекулярной орбитали соблюдены, т.е. если исходные атомные волновые функции близки по энергии и свойствам симметрии, тогда для случая, например, двухатомных молекул орбитальные коэффициенты
- энергетический уровень, достигаемый в результате поглощения. Упрощённо переход между электронными энергетическими уровнями соответствует энергии, необходимой для перемещения электрона с одной молекулярной орбитали на другую. Зависимость вероятности поглощения от длины волны называется спектром поглощения. Задача абсорбционной спектроскопии состоит в накоплении и анализе данных по поглощению. Таким образом, поглощение световой энергии в видимой и УФ – областях, связаны с различным типом электронных переходов. Оптические спектры атомов связаны с квантовыми переходами электронов внешней электронной оболочки. При объединении атомов в молекулу обобществлённые (валентные) электроны образуют внешнюю оболочку и остаются ответственными за оптические спектры. Как показали расчёты, при образовании молекул, имеет место расщепление энергетических уровней. При этом образуются молекулярные орбитали трёх типов – связывающие, разрыхляющие и несвязывающие. Объяснение этому можно дать только с позиций метода молекулярных орбиталей, который позволяет наиболее корректно вскрыть суть данного явления. Так, с точки зрения метода молекулярных орбиталей, молекула рассматривается как единая система ядер и электронов. Волновая функция такой системы будет задаваться как линейная комбинация соответствующих атомных орбиталей. Такой подход получил название метода линейных комбинаций атомных орбиталей (ЛКАО – МО). С позиций данного метода, для образования устойчивой молекулярной орбитали необходимо, чтобы энергии исходных атомных орбиталей были близки друг к другу. При этом последние не должны сильно отличаться по свойствам симметрии. Орбитальные коэффициенты, входящие в выражение полученной таким образом молекулярной волновой функции, будут очевидно определять вклад каждой из комбинируемых базисных волновых функций в образование молекулярной орбитали. Если указанные выше условия образования молекулярной орбитали соблюдены, т.е. если исходные атомные волновые функции близки по энергии и свойствам симметрии, тогда для случая, например, двухатомных молекул орбитальные коэффициенты 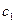 и
и 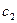 должны быть близкими по своим значениям, а это, в свою очередь, обеспечивает максимальное перекрывание электронных облаков. Так, если при сложении соответствующих исходных (базисных) атомных орбиталей образуется молекулярная орбиталь, энергия, которой понижается относительно энергий атомных орбиталей, то такая молекулярная орбиталь называется связывающей. Волновая функция, соответствующая связывающей орбитали, получается в результате сложения волновых функций с одинаковым знаком. Электронная плотность при этом концентрируется между ядрами, и волновая функция принимает положительное значение. При вычитании атомных орбиталей энергия молекулярной орбитали повышается. Эта орбиталь называется разрыхляющей. Электронная плотность в этом случае располагается за ядрами, а между ними равна нулю. Волновая функция в двух образовавшихся электронных облаках имеет противоположные знаки, что хорошо видно из схемы образования связывающей и разрыхляющей орбиталей:
должны быть близкими по своим значениям, а это, в свою очередь, обеспечивает максимальное перекрывание электронных облаков. Так, если при сложении соответствующих исходных (базисных) атомных орбиталей образуется молекулярная орбиталь, энергия, которой понижается относительно энергий атомных орбиталей, то такая молекулярная орбиталь называется связывающей. Волновая функция, соответствующая связывающей орбитали, получается в результате сложения волновых функций с одинаковым знаком. Электронная плотность при этом концентрируется между ядрами, и волновая функция принимает положительное значение. При вычитании атомных орбиталей энергия молекулярной орбитали повышается. Эта орбиталь называется разрыхляющей. Электронная плотность в этом случае располагается за ядрами, а между ними равна нулю. Волновая функция в двух образовавшихся электронных облаках имеет противоположные знаки, что хорошо видно из схемы образования связывающей и разрыхляющей орбиталей:
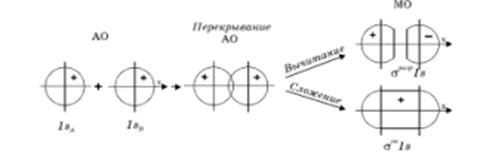
Рис. 28. Схема образования связывающей и разрыхляющей молекулярных орбиталей.
Когда атомная орбиталь одного из атомов вследствие большой разницы в энергии или симметрии не может взаимодействовать с атомной орбиталью другого атома, она переходит в энергетическую схему молекулярных орбиталей молекулы с энергией, соответствующей ей в атоме. Орбиталь этого типа называется несвязывающей. Разделение молекулярных орбиталей на 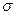 -,
-,  - и
- и 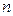 - типы производится в соответствии с симметрией их электронных облаков аналогично
- типы производится в соответствии с симметрией их электронных облаков аналогично 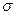 - и
- и  - связям в методе валентных связей:
- связям в методе валентных связей: 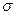 - орбиталь имеет такую симметрию электронного облака, при которой поворот её вокруг оси, соединяющей ядра, на 180° приводит к орбитали, по форме не отличимой от первоначальной. Знак волновой функции при этом не меняется. В случае же
- орбиталь имеет такую симметрию электронного облака, при которой поворот её вокруг оси, соединяющей ядра, на 180° приводит к орбитали, по форме не отличимой от первоначальной. Знак волновой функции при этом не меняется. В случае же  - орбитали при повороте её на 180° знак волновой функции меняется на противоположный. Отсюда следует, что
- орбитали при повороте её на 180° знак волновой функции меняется на противоположный. Отсюда следует, что 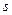 - орбитали атомов при взаимодействии между собой могут образовывать только
- орбитали атомов при взаимодействии между собой могут образовывать только 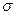 - орбитали, соответственно
- орбитали, соответственно 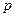 - орбитали – одну
- орбитали – одну 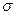 - и две
- и две  - орбитали, причём
- орбитали, причём 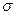 - орбиталь возникает при взаимодействии
- орбиталь возникает при взаимодействии 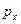 атомных орбиталей, а
атомных орбиталей, а  - орбиталь – при взаимодействии
- орбиталь – при взаимодействии 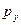 - и
- и 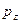 - орбиталей. Молекулярные
- орбиталей. Молекулярные  - орбитали повёрнуты относительно межъядерной оси на 90°, в чём прослеживается полная аналогия данного метода с методом валентных связей.
- орбитали повёрнуты относительно межъядерной оси на 90°, в чём прослеживается полная аналогия данного метода с методом валентных связей.
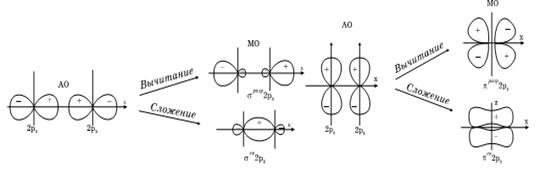
Рис. 29. Схема образования  - связывающих и
- связывающих и  - разрыхляющих молекулярных орбиталей.
- разрыхляющих молекулярных орбиталей.
Рассмотрим типы электронных переходов в молекулах органических соединений в рамках одноэлектронного приближения.
 2015-03-22
2015-03-22 2518
2518
