Электронная плотность. В методе Хюккеля электронная плотность на атоме 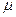 вычисляется по формуле:
вычисляется по формуле:
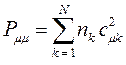
здесь 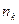 - число электронов на молекулярной орбитали
- число электронов на молекулярной орбитали 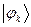 с номером
с номером 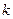 . Воспользовавшись коэффициентами входящими в выражения для связывающих молекулярных орбиталей
. Воспользовавшись коэффициентами входящими в выражения для связывающих молекулярных орбиталей 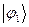 и
и 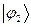 , учитывая при этом, что
, учитывая при этом, что 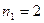 и
и 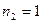 , будем иметь соответственно:
, будем иметь соответственно:
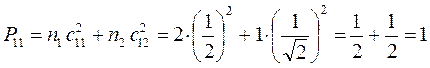
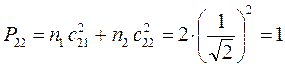
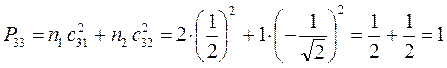
поскольку:
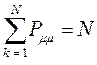
имеем таким образом:
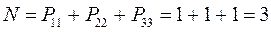
Заряд на атоме. Поскольку в результате делокализации некоторая часть  - электронов сосредотачивается у атома
- электронов сосредотачивается у атома  , то в силу этого, электронная плотность на этом атоме
, то в силу этого, электронная плотность на этом атоме  будет равна
будет равна 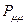 . Очевидно, разность величин
. Очевидно, разность величин 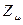 и
и 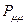 будет определять остаточный заряд, который будет сосредотачиваться у данного атома:
будет определять остаточный заряд, который будет сосредотачиваться у данного атома:
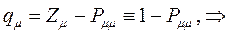
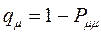
Поскольку, как было показано выше:
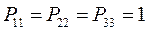
тогда соответственно:
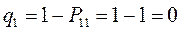
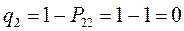
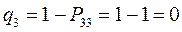
т.е. имеем:
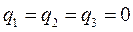
Порядок связи. Поскольку в приближении ЛКАО – МО,  - электроны делокализованны по всей молекуле, то вклад в образование
- электроны делокализованны по всей молекуле, то вклад в образование  - связи между любой парой атомов будут вносить электроны всех заполненных молекулярных орбиталей. В методе Хюккеля порядок связи вычисляют по формуле вида:
- связи между любой парой атомов будут вносить электроны всех заполненных молекулярных орбиталей. В методе Хюккеля порядок связи вычисляют по формуле вида:
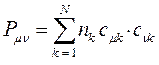
По аналогии с трактовкой 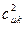 произведение орбитальных коэффициентов
произведение орбитальных коэффициентов 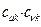 можно интерпретировать как плотность электронов, сосредоточенную между двумя атомами
можно интерпретировать как плотность электронов, сосредоточенную между двумя атомами 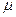 и
и 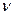 . В общем случае, в приближении Хюккеля, порядок связи будет характеризовать степень
. В общем случае, в приближении Хюккеля, порядок связи будет характеризовать степень  - электронного связывания. Воспользовавшись коэффициентами входящих в выражения для связывающих молекулярных орбиталей
- электронного связывания. Воспользовавшись коэффициентами входящих в выражения для связывающих молекулярных орбиталей 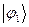 и
и 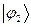 , учитывая при этом, что
, учитывая при этом, что 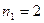 и
и 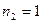 , будем иметь:
, будем иметь:
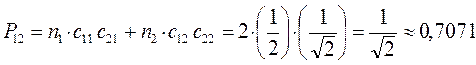
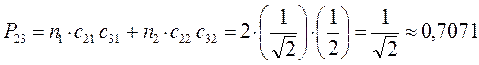
Принимая порядок локализованной 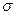 - связи равным единице
- связи равным единице 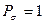 , получим полный порядок кратной
, получим полный порядок кратной 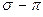 - связи, который будет равен соответственно:
- связи, который будет равен соответственно:
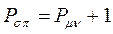
откуда следует, что:
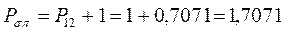
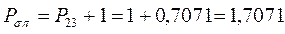
все возможные для данной системы величины 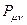 соберём в матрицу плотности первого порядка
соберём в матрицу плотности первого порядка 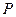 размером
размером 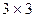 :
:
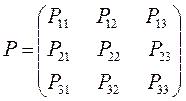
здесь диагональные элементы представляют собой электронные плотности на атомах 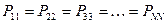 , а недиагональные – порядки связей.
, а недиагональные – порядки связей.
как было установлено:
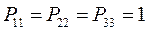
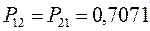
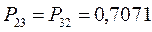
Для построения матрицы плотности первого порядка, рассчитаем также дальние порядки связей, которые для некоторых классов органических реакций могут быть использованы как индексы реакционной способности:
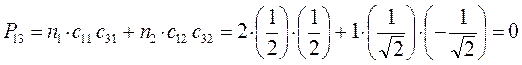
поскольку матрица порядков связей симметрична 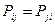 , тогда соответственно:
, тогда соответственно:
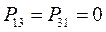
Учитывая приведенные выше данные, строим матрицу порядков связи в виде:
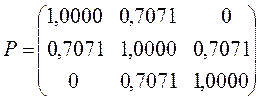
Индекс свободной валентности. Мерой реакционной способности молекулы является индекс свободной валентности, который определяют как разность между максимально возможным полным порядком связей и реальным полным порядком связей данного атома. Индекс свободной валентности на атоме 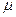 вычисляют по формуле:
вычисляют по формуле:
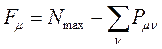
учитывая, что:
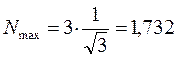
имеем формулу вида:
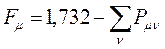
поскольку:
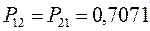
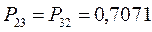
будем иметь соответственно:
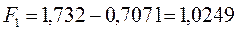
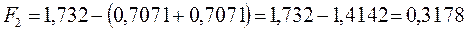
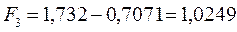
Спиновая плотность. Данная величина является важнейшей характеристикой радикалов, характеризующая пространственное распределение неспаренного электрона. В случае, когда молекулярная орбиталь 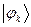 заселена одним электроном, спиновая плотность
заселена одним электроном, спиновая плотность 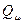 на атоме
на атоме 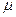 равна квадрату орбитального коэффициента при атомной орбитали с номером
равна квадрату орбитального коэффициента при атомной орбитали с номером 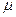 . Величины
. Величины 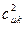 определяют вероятность нахождения неспаренного электрона у данного атома.
определяют вероятность нахождения неспаренного электрона у данного атома.
В общем случае, когда имеется несколько наполовину занятых молекулярных орбиталей, спиновые плотности вычисляются по формуле:
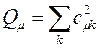
где суммирование проводится по орбиталям, заселённым одним электроном. Из приведенного выше выражения следует, что спиновая плотность на атомах, вычисленная в методе МОХ, всегда положительная величина. Однако из экспериментальных данных и из расчёта в рамках более строгих моделей известно, что спиновая плотность может быть отрицательной величиной. Физически это означает, что в соответствующих положениях преобладают электроны с проекцией спина 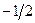 (
(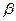 - электроны). Таким образом, имеем соответственно:
- электроны). Таким образом, имеем соответственно:
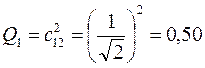
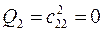
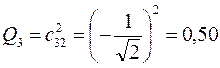
6.2.2. Пентадиенил: 
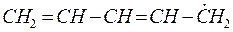
Изобразим граф рассматриваемой радикальной частицы пентадиенила и пронумеруем атомы углерода, входящие в её состав:
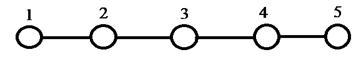
Рис. 26. Граф пентадиенила.
На основании данных о молекулярном графе и виде топологической матрицы (или матрицы смежности), передающих информацию о молекулярной структуре сопряжённых и ароматических соединений, с учётом введенного орбитального параметра 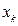 , составим хюккелевский детерминант, порядок которого очевидно будет равен общему числу атомов углерода в молекуле:
, составим хюккелевский детерминант, порядок которого очевидно будет равен общему числу атомов углерода в молекуле:
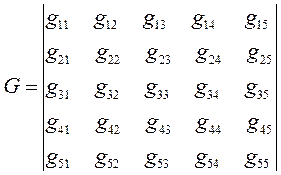
имеем таким образом:
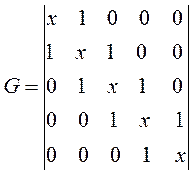
здесь значения диагональных матричных элементов мы положили равными 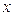 и далее, присвоили значения 1 тем недиагональным матричным элементам, которые соответствуют соседним атомам (между которыми имеет место химическая связь) и нуль тем недиагональным матричным элементам, которые отвечают несоседним атомам (между которыми химической связи нет), приходим к выражению вида. Полученный таким образом детерминант приравняем равным нулю, т.е. имеем:
и далее, присвоили значения 1 тем недиагональным матричным элементам, которые соответствуют соседним атомам (между которыми имеет место химическая связь) и нуль тем недиагональным матричным элементам, которые отвечают несоседним атомам (между которыми химической связи нет), приходим к выражению вида. Полученный таким образом детерминант приравняем равным нулю, т.е. имеем:
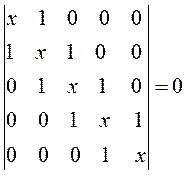
Наиболее простой путь решения детерминанта такого типа является метод, основанный на получении общих решений, предложенный Ч. Коулсоном. Понижение порядка детерминанта такого типа, когда число атомов углерода в молекуле полиена 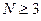 , производится на основании общей формулы вида:
, производится на основании общей формулы вида:
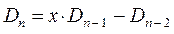
имеем:
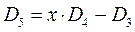
учитывая, что:
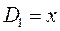
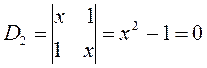
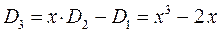
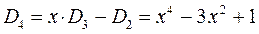
приходим для пентадиена к выражению вида:
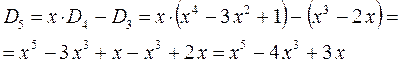
откуда следует соответственно, что:
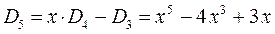
На основании общих решений векового детерминанта, рассчитаем значения орбитальных параметров, энергий и коэффициентов разложения для молекулы пентадиена:
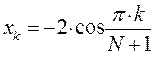
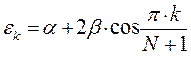
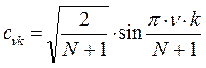
здесь 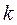 - индекс молекулярной орбитали,
- индекс молекулярной орбитали, 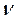 - индекс атомной орбитали и величина
- индекс атомной орбитали и величина 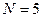 есть число атомов углерода в цепи сопряжения. Поскольку:
есть число атомов углерода в цепи сопряжения. Поскольку:
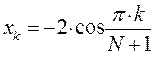
тогда после подстановки соответствующих величин, будем иметь:
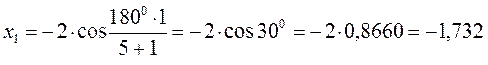
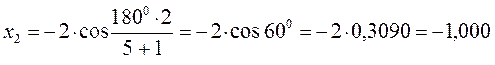
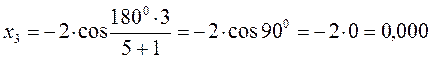
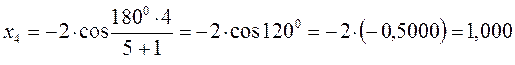
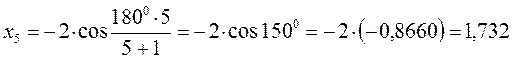
Поскольку:
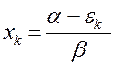
имеем:
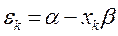
учитывая, что:
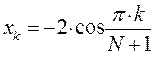
имеем:
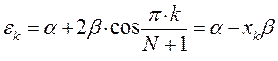
или после подстановки значений орбитальных параметров:
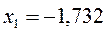 ;
; 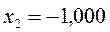 ;
; 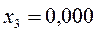 ;
; 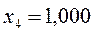 ;
; 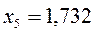
в уравнение вида:
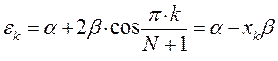
будем иметь соответственно:
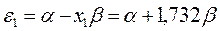
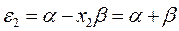
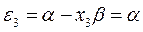
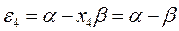
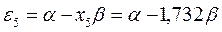
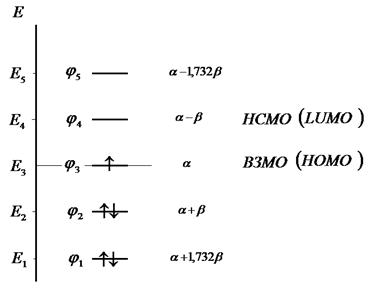
Рис. 27. Диаграмма энергетических уровней пентадиенила.
На основании выражения вида:
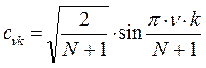
рассчитаем теперь значения орбитальных коэффициентов и построим аналитические выражения для связывающей и разрыхляющей молекулярных орбиталей пентадиена. Учитывая, разложение молекулярной орбитали 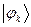 по базисному набору соответствующих атомных орбиталей
по базисному набору соответствующих атомных орбиталей 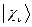 :
:
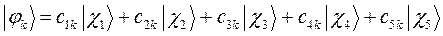
где 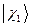 ,
, 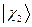 ,
, 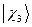 ,
, 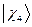 и
и 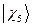 - атомные
- атомные 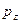 - орбитали слэйтеровского типа. Учитывая также, что
- орбитали слэйтеровского типа. Учитывая также, что 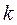 - индекс молекулярной орбитали,
- индекс молекулярной орбитали, 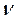 - индекс атомной орбитали и величина
- индекс атомной орбитали и величина 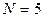 есть число атомов углерода в цепи сопряжения. Рассчитаем орбитальные коэффициенты для самой низкой в энергетическом отношении молекулярной орбитали
есть число атомов углерода в цепи сопряжения. Рассчитаем орбитальные коэффициенты для самой низкой в энергетическом отношении молекулярной орбитали 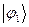 . Учитывая, что:
. Учитывая, что:
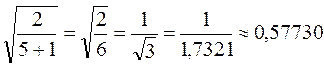
имеем таким образом:
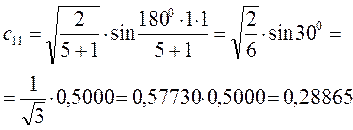
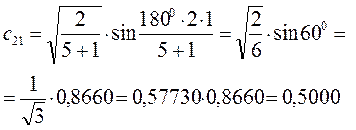
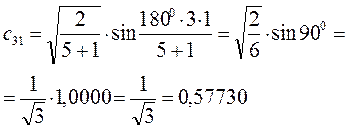
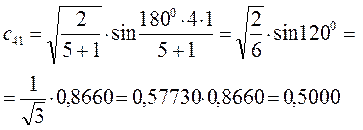
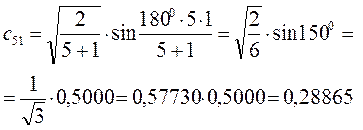
Рассчитаем теперь орбитальные коэффициенты для молекулярной орбитали  , в результате будем иметь соответственно:
, в результате будем иметь соответственно:
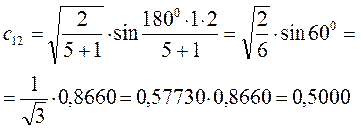
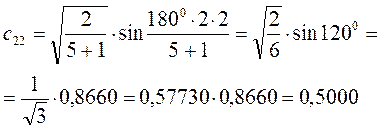
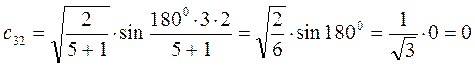
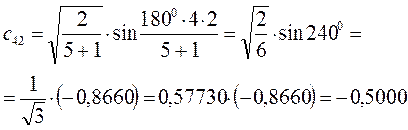
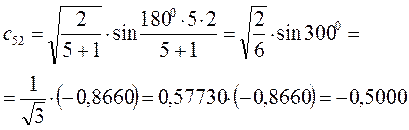
Рассчитаем теперь орбитальные коэффициенты для молекулярной орбитали  , в результате будем иметь соответственно:
, в результате будем иметь соответственно:
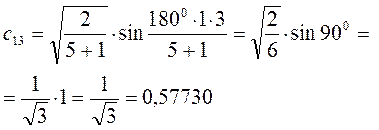
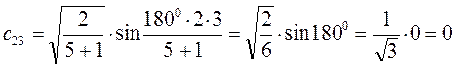
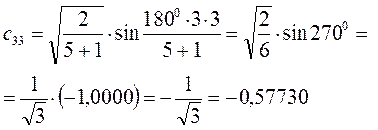
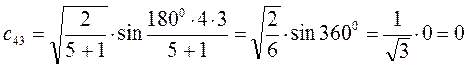
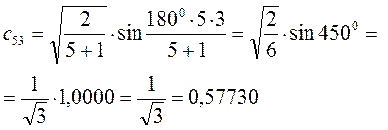
Рассчитаем теперь орбитальные коэффициенты для молекулярной орбитали 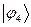 , в результате будем иметь соответственно:
, в результате будем иметь соответственно:
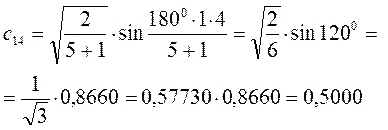
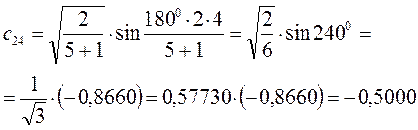
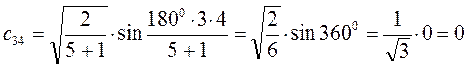
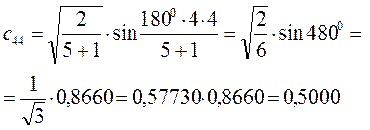
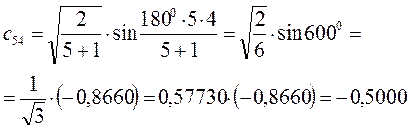
Рассчитаем теперь орбитальные коэффициенты для молекулярной орбитали  , в результате будем иметь соответственно:
, в результате будем иметь соответственно:
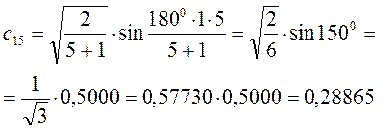
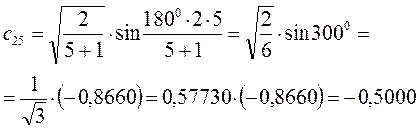
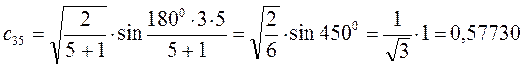
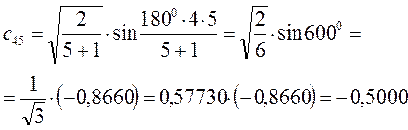
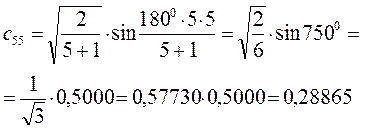
Таким образом, в ходе проделанных выкладок, приходим к выражениям для энергий и соответствующих им волновых функций связывающего, несвязывающего и разрыхляющего состояний пентадиена, полученных в ходе решения хюккелевского детерминанта 5-го порядка 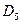 .
.
Таблица 26. Энергии связывающих, разрыхляющих и несвязывающих молекулярных орбиталей.
| Симметрия МО | Орбитальный параметр, 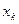 | Энергия МО, 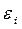 | МО, 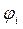 |
 | 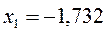 | 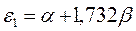 | 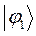 |
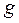 | 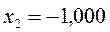 | 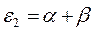 | 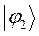 |
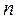 | 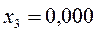 | 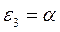 | 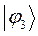 |
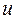 | 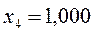 | 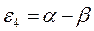 | 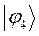 |
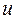 | 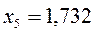 | 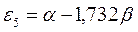 | 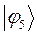 |
Таблица 27. Значения орбитальных коэффициентов.
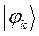 | 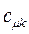 | 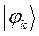 | 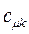 |
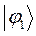 | 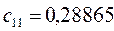 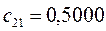 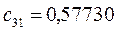 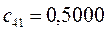 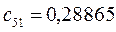 | 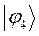 | 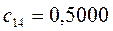 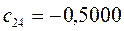 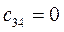 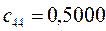 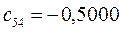 |
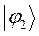 | 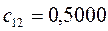 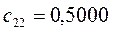 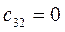 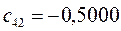 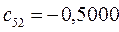 | 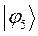 | 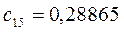 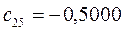 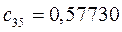 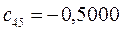 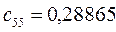 |
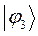 | 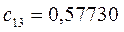 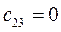 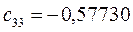 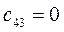 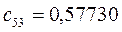 |
поскольку:
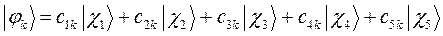
тогда с учётом полученных выше значений для коэффициентов разложения 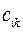 , будем иметь соответственно для волновых функций соответствующих энергетических состояний пентадиена выражения вида, выражения для волновых функций связывающего, разрыхляющего и несвязующего состояний:
, будем иметь соответственно для волновых функций соответствующих энергетических состояний пентадиена выражения вида, выражения для волновых функций связывающего, разрыхляющего и несвязующего состояний:
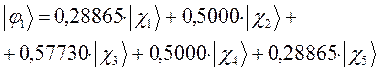
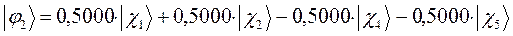
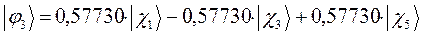
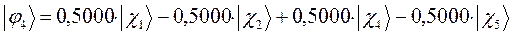
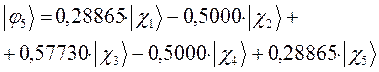
 2015-03-22
2015-03-22 1699
1699








