3. Определяем молярный объем VM кмоля воздуха при заданных температуре и давлении
Один кмоль любых газов при одинаковой температуре и одинаковом давлении занимает один и тот же объем.
Объем одного кмоля VM(0) любого газа при нормальных условиях равен 22,4 м3 и называется молярным объемом.
Нормальные условия: температура t0=0 °С или Т0=273 К; давление Ро=101,325 КПа или 760 мм рт.ст.
Молярный объем газа можно привести к любым другим условиям- температуре и давлению по формуле:
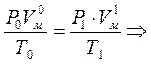
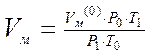 , м3/кмоль;
, м3/кмоль;
где Ро - нормальное давление, Р0=101,3 кПа или Р0=760 мм рт.ст.;
То - нормальная температура, Т0=273 К;
VM(0) - объем одного кмоля газа при нормальных условиях,
VM(0)=22,4 м3 /кмоль;
Р1 - заданное давление, кПа или мм рт.ст.;
Т1 - заданная температура, К;
4. Подсчитывается количество кмолей воздуха по уравнению реакции горения.
5. Составляется пропорция:
Для сгорания кмоля вещества расходуется β 4.76 кмоля воздуха (4,76 кмоля воздуха = 1 кмоль O2 + 3,76 кмоль N2). Один кмоль газа при заданных условиях занимает объем, равный VM. Таким образом, на сгорание одного кмоля горючего вещества (М кг) расходуется 4,76·β·VM м3 воздуха.
Отсюда пропорция будет иметь вид:
М кг/кмоль сгорает в (4,76·β·VM) м3/кмоль воздуха,
m кг сгорает в ---- 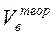 м3.
м3.
Из нее можно получить формулу для определения теоретического объема воздуха, необходимого для сгорания m кг вещества:
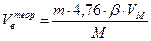 , м3
, м3
 2015-03-27
2015-03-27 2636
2636








