Задача 1. Будет ли одинаковой интенсивность окраски, полученной в реакции с биуретовым реактивом, для растворов альбумина (Mr 64000 D) и иммуноглобулина G (Mr 175000D)одинаковой молярной концентрации? В чем заключается принцип биуретовой реакции?
Ответ. С биуретовым реактивом реагируют пептидные группы белков – образуется хелатный комплекс фиолетового цвета. Изменение окраски раствора при использовании биуретового реактива пропорционально не столько концентрации белка как таковой, сколько количеству пептидных связей. По сравнению с иммуноглобулинами, альбумин содержит меньше остатков аминокислот, так как имеет меньшую молекулярную массу, следовательно, интенсивность окраски раствора альбумина будет меньше при одинаковой молярной массе белков.
Задача 2. В ходе разделения смеси аминокислот хроматографическим методом подавляющее большинство протеиногенных аминокислот дают сине-фиолетовое окрашивание с нингидрином, а пролин и оксипролин – желтое. Объясните это различие, принимая во внимание особенности структуры протеиногенных аминокислот.
Ответ. При нагревании в щелочной среде нингидрина с веществами, имеющими первичные аминогруппы (—NH2), образуется продукт, который имеет устойчивую интенсивную сине-фиолетовую окраску с максимальным поглощением около 570 нм. Нингидриновая реакция также используется для определения вторичных аминогрупп (>NH) в иминокислотах — пролине и оксипролине; в этом случае образуется продукт ярко-жёлтого цвета. Пролин и оксипролин являются иминокислотами, имеющими циклическую структуру, что влияет на структуру окрашенного комплекса с нингидрином и его светопоглощение.
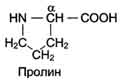
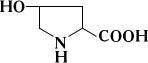 оксипролин
оксипролин
При подготовке к занятию следует изучить обратимые и необратимые методы осаждения белков, их физико-химические свойства согласно таблице 2 и рисунку 3.
Таблица 2.Физико-химические свойства белков.
| Задание | Указания к выполнению задания |
| 1.Изучите суть явления растворимости и осаждаемости белков. | 1. Какие физико-химические свойства белков обусловливают их растворимость? Чем обусловлена различная растворимость глобулярных и фибриллярных белков? Перечислите факторы, определяющие растворимость белков. 2. Приведите два основных фактора стабилизации белка в растворе. 4. В чем суть явления высаливания? 5. Приведите примеры практического использования высаливания. 6. Дайте определение явлению денатурации. Приведите классификацию видов денатурации. 7. Приведите примеры практического использования денатурации белков. |
| 2.Изучите явление появления заряда у белковых молекул. | 1.Выпишите два основных фактора, определяющих заряд белковой молекулы. 2.Напишите, что называется изоэлектрической точкой. Каковы свойства белков в изоэлектрическом состоянии? В какой среде будет находиться изоэлектрическая точка альбуминов и гистонов? |
БЕЛОК В РАСТВОРЕ СТАБИЛИЗИРУЮТ 2 ФАКТОРА – ЗАРЯД И ГИДРАТНАЯ ОБОЛОЧКА
ВЫСАЛИВАНИЕ
ДЕНАТУРАЦИЯ
МЕТОДЫ ОСАЖДЕНИЯ
ДЕГИДРАТАЦИЯ И НЕЙТРАЛИЗАЦИЯ ЗАРЯДА БЕЛКОВЫХ ЧАСТИЦ
НАРУШЕНИЕ ВТОРИЧНОЙ, ТРЕТИЧНОЙ И ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ УТРАЧИВАЕТСЯ
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ СОХРАНЯЕТСЯ
Рисунок 3. Схема «Методы осаждения белка»
Задания для самоконтроля
Выберите один наиболее правильный ответ.
1. ИЗОЭЛЕКТРИЧЕСКАЯ ТОЧКА ПЕПТИДА ГЛИ-АЛА-ВАЛ НАХОДИТСЯ В ЗОНЕ рН
1) нейтральной
2) слабокислой
3) щелочной
2 В ЩЕЛОЧНОЙ СРЕДЕ (рН 10) ДАННЫЙ ПЕПТИД БУДЕТ ДВИГАТЬСЯ К
а) аноду
б) катоду
3. ПРЕРЫВАЕТ a-СПИРАЛИЗАЦИЮ ПОЛИПЕПТИДНОЙ ЦЕПИ
1) тирозин
2) триптофан
3) валин
4) пролин
5) аспарагин
4.НА ПОВЕРХНОСТИ ГЛОБУЛЯРНОГО БЕЛКА, РАСТВОРИМОГО В ВОДЕ, НАИМЕНЕЕ ВЕРОЯТНО РАСПОЛОЖЕНИЕ АМИНОКИСЛОТНЫХ ОСТАТКОВ
1) арг, глу
2) лиз, асп
3) вал, лей
5.НАКАПЛИВАЮЩИЙСЯ В ТКАНИ МОЗГА ПРИ БОЛЕЗНИ АЛЬЦМЕЙГЕРА β-АМИЛОИД ПРЕДСТАВЛЯЕТ СОБОЙ
1)продукт экспрессии мутантного гена
2)нормальный белок с измененной конформацией
3) глобулярный белок с высоким содержанием α-структур
4) нерастворимые фибриллы с β-складчатой структурой
6.НАИБОЛЕЕ ОПТИМАЛЬНЫЙ МЕТОД ОСАЖДЕНИЯ БЕЛКА С ЦЕЛЬЮ ДАЛЬНЕЙШЕГО ИСПОЛЬОВАНИЯ ЕГО БИОЛОГИЧЕСКОЙ АКТИВНОСТИ
1)осаждение органическими кислотами
2)осаждение гуанидинхлоридом
3)осаждение солями тяжелых металлов
4)высаливание
5)обработка парахлормеркурибензоатом или йодацетатом
7. ПРИ РАЗДЕЛЕНИИ БЕЛКОВ СЫВОРОТКИ КРОВИ ВЫСАЛИВАНИЕМ ОЧИСТИТЬ ИХ ОТ СУЛЬФАТА АММОНИЯ ПОЗВОЛЯЕТ
1) хроматография
2) спектроскопия
3) высушивание при 1000С
4) диализ
5)рефрактометрия
8.ПРИОНОВЫЕ БЕЛКИ
1)способствуют поддержанию нативной конформации белка
2)нарушают нативную конформацию белка, приводя к образованию функционально неактивных агрегатов
3)легко гидролизуются протеолитическими ферментами
4)устойчивы к действию протеаз
5)участвуют в фолдинге белков
 2015-03-08
2015-03-08 1804
1804








