Если погрузить Ме в водный раствор его соли, то «+» ионы, находящиеся на поверхности металла, гидратируются и некоторое количество ионов переходит в раствор. В результате на пластине образуется избыток электронов, она заряжается «-»
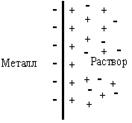 Между металлом и раствором устанавливается равновесие:
Между металлом и раствором устанавливается равновесие:
МТВ + nН2О - z ē ↔ М(Н2О)nz+
Катионы, притягиваясь к отрицательно заряженной пластине, концентрируются вблизи нее. Анионы отталкиваются от пластины и их концентрация вблизи электрода будет понижена.
Раствор вблизи поверхности Ме приобретает заряд, противоположный по знаку заряду металла – образуется двойной электрический слой и возникает определенный скачок потенциала, который принято называть электродным потенциалом(φ).
Значение электродного потенциала зависит:
1.От природы металла – чем большей химической активностью обладает металл, тем легче он растворяется, тем отрицательней потенциал;
2. От концентрации ионов металла в растворе – с увеличением концентрации катионов в растворе потенциал становится более положительным;
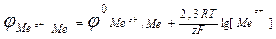 3. От температуры – с повышением температуры потенциал становится более положительным.
3. От температуры – с повышением температуры потенциал становится более положительным.
 2015-04-12
2015-04-12 362
362








