Окислительно - восстановительные реакции (ОВР)
Реакции, протекающие с изменением степени окисления, называются окислительно – восстановительными.
Степень окисления – условный заряд атома в соединении, вычисленный из предположения, что оно состоит только из ионов.
• «─» степень окисления имеют атомы, которые приняли электроны от других атомов или в их сторону смещены связующие электронные облака.
• «+» степень окисления имеют атомы, которые отдали свои электроны другим атомам.
• «0» степень окисления имеют атомы в молекулах простых веществ.
Правила определения степени окисления
• 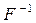 самый электроотрицательный элемент, во всех соединениях -1.
самый электроотрицательный элемент, во всех соединениях -1.
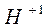 |
• за исключением гидридов металлов
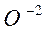
• 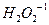 постоянная степень окисления –2, за исключением:
постоянная степень окисления –2, за исключением:
пероксида водорода
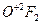 фторида кислорода
фторида кислорода
• В пероксидах и дисульфидах содержатся двухатомные мостики [-O-O-], [-S-S-] - степени окисления атомов O и S этих соединениях равна ─1.
• Атомы элементов I-III групп ПС, отдающие свои электроны, имеют постоянную «+» степень окисления, равную номеру группы.
Исключение:Cu (+1,+2),
Au (+1,+3),
Hg (+1,+2).
• Атомы элементов главных подгрупп IV-VI групп могут проявлять несколько степеней окисления.
– Высшую «+», равную номеру группы
– Промежуточную, на 2 единицы меньше, чем высшая,
– Низшую «─», равную разности между номером группы и число 8
Исключение:N (+1,+2,+3,+4,+5, -3)
• Атомы металлов могут иметь только «+» степень окисления.
• Атомы элементов VII группы, главной подгруппы – галогены (кроме фтора) могут иметь в соединениях все нечетные степени окисления от ─1 до +7 (─1, +1, +3,+5,+7)
• Алгебраическая сумма степеней окисления в соединение равна 0, а в сложном ионе – заряду иона.
 2015-04-12
2015-04-12 1207
1207