· Повышение нормального автоматизма - связано со снижением МДП до 40-60 мВ (в норме 65-80) в клетках, обладающих спонтанной МДД. Может возникать в клетках САУ под воздействием самых разных факторов.
· Патологический автоматизм - возникает во вспомогательных предсердных пейсмекерах, АВУ, системе Гиса-Пуркинье и, крайне редко, в клетках сократительного миокарда, где в норме такой активности не наблюдается. Как правило, при возникновении эктопических тахикардий (как желудочковых, так и суправаентрикулярных) аномальная активность развивается в клетках, обладающих способностью к медленной диастолической деполяризации. Это приводит к формированию парасистолии, очаговой (фокусной) предсердной тахикардии и другим аритмиям.
Триггерная активность является следствием вторичных подпороговых осцилляций мембранного потенциала. При определенных условиях амплитуда таких колебаний мембранного потенциала может возрастать, и, достигнув порога возбуждения, вызывать наведенный (триггерный) импульс – преждевременный ПД. Постдеполяризации подразделяются на ранние (наблюдающиеся во 2 и 3 фазу ПД) и поздние (возникающие в период ПП).
· Ранние постдеполяризации - наблюдаются при замедлении реполяризации и удлинении ПД за счет замедления выходящего калиевого тока. Эти постдеполяризации ответственны за желудочковую тахикардию по типу torsades de points. Препараты, удлиняющие QT (1А, 3 класс ААП, катехоламины), способствуют их возникновению
· Отсроченные постдеполяризации - возникают при перегрузке клетки кальцием. Критическое повышение уровня кальция может запускать повторный вход натрия и деполяризацию мембраны. Классический пример аритмий, связанных с этим механизмом – нарушения ритма при гликозидной интоксикации. Перегрузка клеток кальцием может наблюдаться также при чрезмерной симпатической стимуляции, а также воспалительных и ишемических изменения в миокарде, приводящих к нарушению работы АТФ-зависимых насосов.
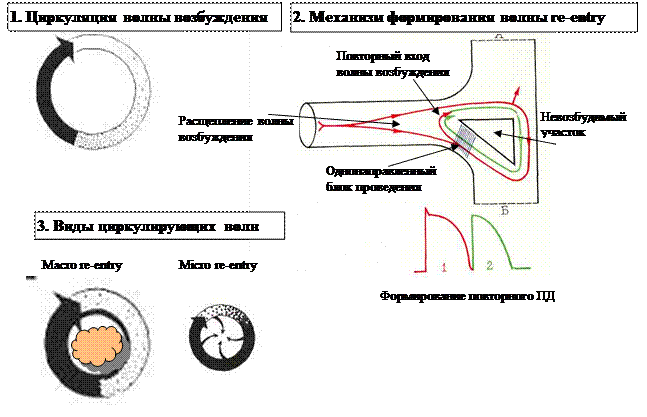
Циркуляция возбуждения re-entry. Под термином re-entry понимают движение волны возбуждения по замкнутому кругу, при котором импульс возвращается к месту своего возникновения и повторяет движение (рисунок 9-1). Такое нарушение ритма возникает уже не в одной клетке, а в ткани миокарда. Для возникновения круга re-entry необходимо наличие на пути волны возбуждения анатомически или электрофизиологически невозбудимого участка (вокруг которого может циркулировать волна возбуждения), а также локального однонаправленного блока в одном из сегментов петли (рисунок 9-2). Обычно, волна возбуждения, обогнув невозбудимый участок с обеих сторон, распространяется по миокарду дальше. Однако, при сочетании полностью невозбудимого участка с наличием однонаправленного блока в одном из прилегающих отделов, волна возбуждения огибает препятствие только с одной стороны, подходит к частично блокированному участку с обратной стороны и возвращается ретроградно. В случае однократного возврата импульса мы увидим экстрасистолу, при закреплении циркуляции волны re-entry мы столкнемся с пароксизмальной реципрокной (т.е. возвратной) тахикардией. Это наиболее частый механизм развития аритмий. Для реализации этого механизма необходимо появление электрофизиологической гетерогенности миокарда, что часто встречается при ишемии тканей, после перенесенного инфаркта, миокардита, при кардиомиопатии (как дилатационной, так и особенно гипертрофической). Существует два основных варианта петель re-entry: macro re-entry и micro re-entry (рисунок 9-3). В первом случае имеется анатомический субстрат невозбудимого участка (например, рубец или наличие дополнительного АВ соединения при синдроме WPW – в этом случае петля имеет постоянную форму и довольно успешно лечится с помощью хирургических методов). Во втором случае участок миокарда становится невозбудимым под воздействием обратимых причин (глубокая ишемия, электролитный дисбаланс) – в этом случае аритмический очаг может исчезать на фоне патогенетической терапии и возникать вновь на другом участке при усугублении ишемии.
Рисунок 10. Механизм возникновения и циркуляции волны re-entry
Вообще нужно отдельно остановиться на роли ишемической болезни сердца (ИБС) в развитии аритмий, так как она является наиболее распространенной причиной возникновения жизненно опасных НРС. Причем формирование аритмий может происходить по самым различным сценариям. Ишемия является причиной снижения внутриклеточных запасов АТФ, что ведет к открытию АТФ-чувствительных калиевых каналов и выходу К+ из клетки. Это приводит к частичной деполяризации клеточной мембраны (т.е. уменьшению потенциала покоя) и, как следствие, к снижению сократимости в целях экономии запасов АТФ. Однако уменьшение потенциала покоя ведет к формированию эктопической активности (по механизмам аномального автоматизма и триггерной активности), особенно в клетках, которым присущ физиологический автоматизм. Дальнейшая деполяризация подавляет любую электрическую активность клетки. Ишемия различной глубины в отдельных участках миокарда приводит к появлению гетерогенности электрофизиологических свойств миокарда. Это является причиной формирования кругов re-entry. Одновременно происходит нарушение работы АТФ-зависимых насосов, удаляющих Ca++ из клетки, что приводит к перегрузке клетки кальцием. Изначально это компенсаторный механизм, призванный сохранить сократительную способность миокарда, однако он значительно нарушает диастолическую функцию миокарда. Кроме того, повышение кальция в цитоплазме не влечет за собой накопление его в депо (в саркоплазматическом ретикулуме) и таким образом, не способствует повышению сократимости. Перегрузка клетки кальцием приводит к аритмиям по механизму триггерной активности. Одновременно ишемия является стрессорным фактором, приводящим к нарушению нейрогуморальной регуляции и провоцирующим возникновение аритмий.
Как уже упоминалось выше, нарушения ритма сердца (НРС) могут возникать на фоне ИБС, хронической сердечной недостаточности (ХСН), врожденные и приобретенных пороках сердца (ВПС и ППС), эндокринной или неврологической патологии, кардиомиопатии (КМП) - гипертрофической, дилатационной, аритмогенной правого желудочка. Это особенно важно учитывать в связи с тем, что одни и те же аритмии на фоне различных заболеваний и степени структурной сердечной патологии имеют разный прогноз с точки зрения жизни пациента и риска внезапной смерти. Практически все авторы едины во мнении, что антиаритмическая терапия должна назначаться только на фоне патогенетического лечения (1, 2, 3, 4, 5, 11).
 2015-04-01
2015-04-01 1837
1837








