Общая характеристика элементов
Ti
ns2np1 – электронная формула последнего уровня p
|
|
 |

 | |||
|

| Химические свойства Al | ||
1) 4Al + 3O2 = 2Al2O3 – покрывается прочной пленкой оксида 2) 2Al + 3Cl2 = 2AlCl3 (Br2, I2) – на холоде 3) 2Al + 3S = Al2S3 (N, C) – при нагревании 4) 2Al + 6H2O = Al(OH)3 + 3 H2↑ 5) 2Al+NaOH+6H2O=2Na[Al(OH)4]+ 3H2↑ – растворяется в щелочах гидроксоалюминат 6)
7) 8) Al + HNO3(конц.) = Al(NO3)3 + 3NO2↑ + 3H2O |
| Алюмотермия– получение металлов (Fe, Cr, Mn, Ti, W) из их оксидов: 8Al + 3Fe3O4 = 4Al2O3 + 9Fe (термит) |
| Применение: Al – конструкционный материал, входит в состав сплавов, например: дюралюминий (с 5% Cu и 2% Mg) и др.; устойчив к коррозии; алюминиевые бронзы (Cu + 5% Al) – для чеканки монет; пигмент краски «серебрянки»; в металлургии – для получения металлов; для сварки стали. |
СОЕДИНЕНИЯ Al3+
| Оксид Al2O3 (корунд) | Гидроксид Al(OH)3 | ||
| Белые, твердые вещества, не растворяются в воде. | |||
| Получение | |||
| 1) Очистка природных соединений 2) В лаборатории: 4Al + 3O2 = 2Al2O3 (сжигание в O2) 2Al(OH)3 = Al2O3 + H2O (прокаливание) | 1) Осаждение из солей AlCl3 + 2NaOH = Al(OH)3↓+NaCl Al2S3 + 6H2O =2Al(OH)3↓+3H2S↑ Na[Al(OH)4]+HCl=Al(OH)3+NaCl+H2O | ||
| Амфотерные свойства | |||
| 1) Al2O3 + 6HCl = AlCl3 + 3H2O 2) Al2O3+2NaOH+7H2O= 2Na[Al(OH)∙(H2O)2] 3) Al2O3 + 2NaOH = 2NaAlO2 + H2O (сплавление) | 1) Al(OH)3 + 3HCl = 3H2O+ lCl3 2) Al(OH)3 + NaOH=Na[Al(OH)4] | ||
Элементы IVА группы
 2015-04-01
2015-04-01 1218
1218

 B
B возрастают Al
возрастают Al металлические Ga
металлические Ga
 свойства In
свойства In

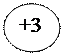 s
s

 бокситы – Al2O3·nH2O; глины – Al2O3·nSiO2; нефелины – KNa3[AlSiO4]4; корунд – минерал Al2O3; криолит – минерал AlF3·3NaF или Na3[AlF6]
бокситы – Al2O3·nH2O; глины – Al2O3·nSiO2; нефелины – KNa3[AlSiO4]4; корунд – минерал Al2O3; криолит – минерал AlF3·3NaF или Na3[AlF6]  2Al + 6H2SO4(конц.) = Al2(SO4)3 + 3SO2↑ +6H2O
2Al + 6H2SO4(конц.) = Al2(SO4)3 + 3SO2↑ +6H2O






