Кинетика – учение о скорости различных процессов, в том числе химических реакций. Скорость химических реакций зависит от многих факторов, основные из которых: концентрация (давление) реагентов, температура и действие катализатора. Эти же факторы определяют и достижение равновесия в реагирующей системе.
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант – Гоффа по формуле:
υt2 = υt1 · γ 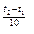
Правило Вант – Гоффа может быть выражено иначе:
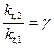
 Пример 1. Во сколько раз изменятся скорости прямой (υ) и обратной реакций (υ) в системе:
Пример 1. Во сколько раз изменятся скорости прямой (υ) и обратной реакций (υ) в системе:
2SO2 (г) + О2 (г) ↔ 2SO3 (г),
если объем газовой смеси уменьшить в два раза? В какую сторону сместится равновесие системы?
Решение. Обозначим равновесные концентрации веществ: [SO2] = a, [O2] = b, [SO3] = c. Согласно закону действия масс, скорости прямой и обратной реакций до изменения объема равны:
υ = k · а2 · b; υ = k · c2
→ → ← ←
После уменьшения объема гомогенной системы в 3 раза концентрация каждого вещества увеличится в 3 раза: [SO2] = 3a, [O2] = 3b, [SO3] = 3c. При новых концентрациях скорости прямой и обратной реакции будут равны:
υ' = k · (3a)2 · 3b = 27 k · a2 · b = 27 υ
→ → → →
υ' = k · (3a)2 = 9 k · c2 = 9 υ
← ← ← ←
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в 9 раз. Равновесие сместилось в сторону образования SO3 (вправо).
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 300С до 700С, если температурный коэффициент реакции равен 2.
Решение. 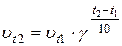 или
или 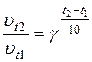
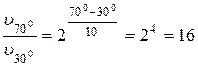
Следовательно, скорость протекания реакции при 700С больше скорости реакции при 300С в 16 раз.
Пример 3. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению:
РСl5 (г) ↔ РСl3 (г) + Cl2 (г); ΔН = +92,59 кДж
1 моль 1 моль 1 моль
Σ = 2 моль
Как надо изменить: а) температуру; б) давление; в) концентрации, чтобы сместить равновесие вправо, т.е. в сторону прямой реакции?
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле-Шателье:
а) так как реакция разложения РСl5 эндотермическая (ΔН > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру;
б) так как прохождение прямой реакции сопровождается увеличением числа молей, следовательно, увеличением давления, то способствовать ей будет уменьшение давления;
в) смещение равновесия в прямом направлении можно достигнуть как увеличением концентрации РСl5, так и уменьшением концентраций РСl3 и Cl2.
 2015-04-30
2015-04-30 381
381








