Термодинамический анализ реакций, протекающих в сложных газовых атмосферах, позволяет лишь судить о возможности протекания реакции в прямом или обратном направленях и рассчитать состав газовой фазы. Однако при этом невозможно рассмотреть механизм процессов взаимодействия и провести их кинетический анализ.
Механизм взаимодействия валентно насыщенных молекул должен включать разрыв или ослабление валентных связей. Это требует больших энергетических затрат, что не может быть компенсировано только энергией теплового движения молекул. Как показывают экспериментальные данные, все реакции горения имеют цепной механизм, характеризующийся участием активных центров (частиц) – атомов и радикалов со свободными валентностями. Простейшие акты многостадийного процесса окисления начинаются после образования активных центров и протекают как химические реакции между ними и молекулами с небольшой энергией активности. Особенностью таких реакций является воспроизводство активных центров. По характеру своего протекания цепные реакции делятся на неразветвленные, разветвленные и с вырожденным разветвлением.
Вообще же модельной в теории цепных реакций является наиболее изученная реакция горения водорода, для которой характерно малое число промежуточных продуктов и хорошо выделяемые элементарные акты. Ими являются:
1) реакции образования активных центров в объёме смеси и на стенке сосуда:
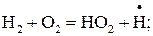
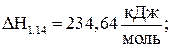 Е1.14 = 198,55 кДж/моль; (1.14)
Е1.14 = 198,55 кДж/моль; (1.14)
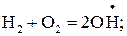
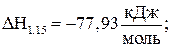 Е1.15 = 180,7 кДж/моль; (1.15)
Е1.15 = 180,7 кДж/моль; (1.15)
Надс + О2 = НО2; (1.16)
2) реакция продолжения цепи:
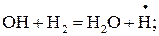
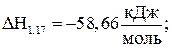 Е1.17=41,9кДж/моль; (1.17)
Е1.17=41,9кДж/моль; (1.17)
3) реакции разветвления цепей:
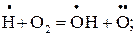
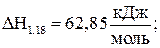 Е1.18 = 63,27 кДж/моль; (1.18)
Е1.18 = 63,27 кДж/моль; (1.18)
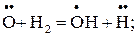
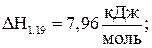 Е1.19 = 25,14 кДж/моль; (1.19)
Е1.19 = 25,14 кДж/моль; (1.19)
4) реакция обрыва цепей (дезактивации) на стенке
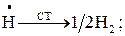
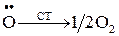 ; (1.20)
; (1.20)
5) реакция обрыва цепей в объеме газовой фазы (М – нейтральная молекула):
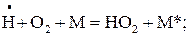 Е(1.21)» 0; DН1.20 = - 197 кДж/моль. (1.21)
Е(1.21)» 0; DН1.20 = - 197 кДж/моль. (1.21)
Скорость каждой из указанных реакций определяется парциальным давлением Р и порядком реакции n и в общем виде может быть представлена в виде
V = const × 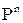 . (1.22)
. (1.22)
Анализ кинетических характеристик реакций (1.14)–(1.21) свидетельствует, что скорость процесса горения водорода в итоге определяется протеканием реакции (1.17) и равна скорости образования активных центров ОН (в условиях стационарности).
Воспламенение же газовой смеси (Н2 + О2) будет возможно тогда, когда скорость образования активных центров больше скорости их исчезновения на стенке и в объеме. Условия воспламенения газовой смеси (Н2 + О2) показаны на рис. 1.3, где четко выделяется так называемый «полуостров воспламенения».
Если нижний предел воспламенения – в интервале давлений Р1 – Р2 при Т1 – связан с геометрией, размерами и адсорбционной способностью материала стенок сосуда, то верхний предел воспламенения (при Р3) имеет тепловую природу и определяется температурой и свойствами инертных частиц, обозначаемых в уравнении (1.21) как М.
Общим закономерностям цепных реакций подвержена и реакция горения СО, являющаяся одной из важных в металлургии.
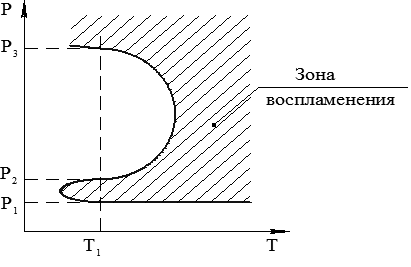
Рис. 1.3. Условия воспламенения газовой смеси (Н2 + О2)
 2015-05-05
2015-05-05 824
824








