Основным условием протекания масообменых процессов является нарушение равновесия между фазами, которое может произойти при изменении температуры, давления или концентрации хотя бы одной из фаз. Процесс при этом будет происходить до тех пор пока вновь не установится равновесие. При равновесии не прекращается молекулярное движение и перенос вещества. а наступает равновесие в переносе вещества из одной фазы в другую и обратно.
Однокомпонентное равновесие системы может состоять из 1, 2, 3-х фаз находящихся в равновесии в соответствии с правилом Гиббса:
S=K-f+2
K-количество компонентов
f-число фаз
S-число степеней свободы
Для случая одной фазы f=1 S=1-1+2=2 т.е.если в объеме имеются только пары воды то температура и давление могут меняться произвольно.
Для двух фаз S=1-2+2=1 если в замкнутой системе в равновесии находятся вода и водяной пар то давление и температура связаны между собои строго определенной зависимостью.
Три фазы (лед,вода,водяной пар) могут существовать лишь при единственном значении темпер. и давления. S=1-3+2=0.
У двух компонентной системы (этиловый спирт, вода)сост из двух фаз –жидк и вода S=2-2+2=2.
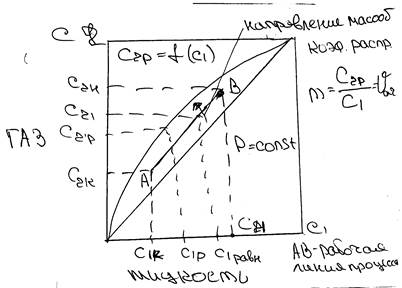
Равновесные условия могут быть достигнуты изменением 2 х параметров. Если установить пост давление то в сост равновесия каждой концентрации С1 какого нибудь компонента в одной фазе соответствует концентрации С2р этого же компонента в другой фазе. Эту зависимость С2р=f(τ1) можно редставить графически в виде диаграммы равновесия:
 2015-05-05
2015-05-05 2343
2343
