Напомним, что кислотно-основное состояние — это соотношение концентраций во-•родпых (Н+) и гидроксильных (ОН-) ионов во внутренней среде организма. Кислот-1Я или щелочная реакция раствора зависит от содержания в нем водородных ионов, икааателем этого содержания служит величина рН, которая представляет собой отри-пельиый десятичный логарифм молярной концентрации ионов Н+:
рН = - lg [H+J.
Это означает, например, что при рН = 7,4 (нейтральная реакция среды) концептра-1я ионов Н+, т.е [Н+], равна Ю-'-4 ммоль/л. При повышении кислотности биологиче-среды ее рН снижается, а при уменьшении кислотности — увеличивается.
Величина рН — это один из самых «жестких» параметров крови. Его колебания норме крайне незначительны: от 7,35 до 7,45. Даже небольшие отклонения рН от нор-i.'iiaioro уровня в сторону уменьшения (ацидоз) или увеличения (алкалоз) приводят существенному изменению окислительно-восстановительных процессов, активности •рментов, проницаемости клеточных мембран, и к другим нарушениям, чреватым ЕВСНЫМИ последствиями для жизнедеятельности организма.
Концентрация водородных ионов почти полностью определяется соотношением би-рбоната и углекислоты:
нсо3- и,со3"
Содержание этих веществ в крови тесно связано с процессом переноса кровью угле-СЛОГО газа (С02) от тканей к легким. Как видно из рис. 2.9, физически растворенный 02) диффундирует из тканей в эритроцит, где под воздействием фермента карбоаи-Кразы происходит гидратация молекулы (С02) с образованием угольной кислоты 'гСОз), немедлепио диссоциирующей с образованием ионов бикарбоната (НСОз-) водорода (Н+):
С02 + Н20 «Н2С03 о нсо3- + н+.
Часть накапливающихся в эритроцитах ионов НСОз", согласно концентрационному |ни пту, выходит в плазму. При этом в обмен на ион НСОЗ- в эритроцит поступают пы хлора (С1~), благодаря чему равновесное распределение электрических зарядов
нарушается.
Попы 1Г, образующиеся при диссоциации углекислоты, присоединяются к молекуле иоглобипа. Наконец, часть С02 может связываться путем непосредственного присое-иепия к аминогруппам белкового компонента гемоглобина с образованием остатка рбаминовой кислоты (ЫНСООН).Таким образом, в крови, оттекающей от тканей,
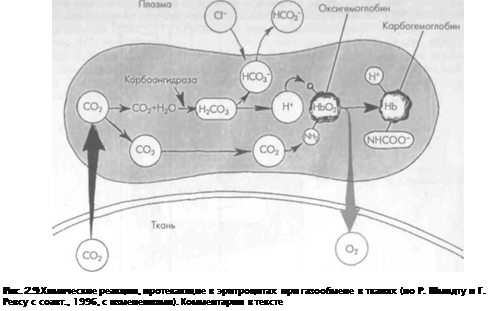
от 27% СС»2 переносится в виде бикарбоната (НСОз-) в эритроцитах, 11% СОг образует карбамиповое соединение с гемоглобином (карбогемоглобин), около 12% СОг остается в растворенной форме или в форме недиссоциироваппой угольной кислоты (НгСОз), а остальное количество СО2 (около 50%) растворено в виде НСОз- в плазме.
На рис. 2.10 схематически изображен ионный состав плазмы здорового человека. Слева представлена концентрация катионов, справа — анионов. Электропейтральность плазмы обеспечивается постоянным равновесием содержания катионов и анионов. Это означает, что изменение концентрации одного из ионов влечет за собой адекватное изменение концентрации других ионов (катионов или анионов). Например, уменьшение содержания хлора (О-) приводит либо к увеличению концентрации другого аннона (чаще — бикарбоната), либо к соответствующему уменьшению концентрации (выведению из организма) катиона натрия Na+, и т.п.
Как показано на рисунке, в норме концентрация бикарбоната (НСОз-) в плазме KpQ ви в 20 раз выше, чем углекислоты (Н2СО3). Именно при таком соотношении НСОз" и Н2СО3 сохраняется нормальная рН, равная 7,4. Если изменяется концентрация биклр боната или углекислоты, их соотношение меняется, и рН смещается в кислую (ацидоз) пли щелочную (алкалоз) сторону. В этих условиях нормализация рН требует подключения ряда компенсаторных регуляторных механизмов, восстанавливающих прежнее соотношение кислот и оснований в плазме крови, а также в различных органах и тканях. Наиболее важными из таких регуляторных механизмов являются:
1. Буферные системы крови и тканей.
2. Изменение вентиляции легких.
3. Механизмы почечной регуляции кислотно-основного состояния.
1. Буферные системы крови и тканей состоят из кислоты и сопряженного оспина пия. При взаимодействии с кислотами последние нейтрализуются щелочным компонентом буфера, при контакте с основаниями их избыток связывается с кислотным компонентом.
Бикарбонатный буфер имеет щелочную реакцию и состоит из слабой угольной кислоты (Н2СО3) и ее натриевой соли — бикарбоната натрия (NaI-ТСОз) в качестве сопряженного основания. При взаимодействии с кислотой щелочной компонент бикарбонатного буфера (ЫаНСОз) нейтрализует ее с образованием Н2СОЗ, которая
Рис. 2.10. Ионный состав плазмы
Н2С03

©
HP042"
SO<2"
' Органические кислоты
Са2* Мд2*
Белки
Катионы Анионы
диссоциирует на СО2 и НгО. Избыток удаляется с выдыхаемым воздухом. При взаимодействии с основаниями кислотный компонент буфера (Н2СО3) связывается избытком оснований с образованием бикарбоната (НСОз-), который затем выделяется почками.
Фосфатный буфер состоит из одноосновного фосфата натрия (ЫаНгРОД играющего роль кислоты, и двухосновного фосфата натрия (NafyPOt), выступающего в роли сопряженного основания. Принцип действия этого буфера тот же, что и бикарбонатного, однако его буферная емкость невелика, поскольку содержание фосфата в крови низкое.
Белковый буфер. Буферные свойства белков плазмы (альбумина и др.) и гемоглобина эритроцитов связаны с тем, что входящие в их состав аминокислоты содержат как кислые (СООН), так и основные (NH2) группы, и могут диссоциировать с образованием кик водородных, так и гидроксильпых ионов в зависимости от реакции среды. Большая часть буферной емкости белковой системы приходится на долю гемоглобина. В физиологическом диапазоне рН оксигемоглобип является более сильной кислотой, чем дезок-(пгемоглобип (восстановленный гемоглобин). Поэтому, освобождая в тканях кислород, восстановленный гемоглобин приобретает более высокую способность к связыванию ионов И' (см. рис. 2.9). При поглощении кислорода в легких гемоглобин приобретает свойства кислоты.
Запомните: Буферные свойства крови обусловлены, по сути, суммарным эффектом всех анионных групп слабых кислот, важнейшими из которых являются бикарбонаты и анионные группы белков («протеинаты»). Эти анионы, обладающие буферными эффектами, получили название буферных оснований (buffer bases, ВВ).
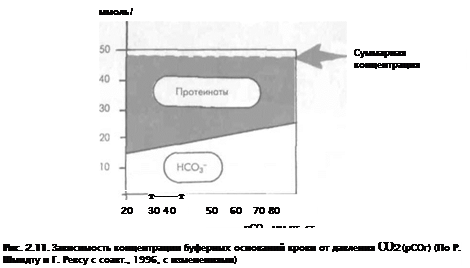
Суммарная концентраты буферных оснований крови составляет около АН ммоль/л и не зависит от сдвигов давления СОг в крови. Действительно, при увеличении давЛС пня СОа в крови (рис. 2.11) образуются равные количества Н* и НСОз". Белки СВЯЗИ* нают ноны IIчто ведет к уменьшению концентрации «свободных» протеинов, обладающих буферными свойствами. Одновременно во столько же раз увеличивается содержание бикарбоната, а суммарная концентрация буферных оснований остается прежней. Наоборот, при уменьшении давления СОг в крови увеличивается содержание п|Х)теипатов и уменьшается концентрация бикарбоната.
Если же в крови изменяется содержание нелетучих кислот (молочной кислоты при гипоксии, ацстоуксусиой и р-оксимасляной — при сахарном диабете и т.п.), Суммарная концентрация буферных оснований будет отличаться от нормальной.
Запомните: Отклонение содержания буферных оснований от нормального уровня (48 ммоль/л) называется избытком оснований (base excess, BE); в норме он равен нулю. При патологическом увеличении количества буферных оснований BE становится положительным, а при уменьшении отрицательным. В последнем случае правильнее использовать термин «дефицит оснований».
Показатель BE позволяет судить, таким образом, о сдвигах «резервов» буферных оснований при изменении содержания нелетучих кислот в крови, и диагностирова 11 даже скрытые (компенсированные) сдвиги кислотно-основного состояния.
2. Изменение легочной вентиляции является вторым регуляториым механизмом, обеспечивающим постоянство рН плазмы крови. При прохождении крови через легкие в эритроцитах и плазме крови происходят реакции, обратные тем, которые описаны выше (рис. 2.12):
Н+ + НСОз" <^> н2со3 <=> со2 + н2о.
Это означает, что при удалении из крови СОг в ней исчезает примерно эквивалент иое число иопов Н\ Следовательно, дыхание играет чрезвычайно важную роль в под держании кислотно-основного состояния. Так, если в результате нарушений обмена вс шести в тканях кислотность крови увеличивается и развивается состояние умеренного метаболического (переспираторпого) ацидоза (см. ниже), рефлекторио (дыхательный центр) возрастает интенсивность легочной вентиляции (гнпервептнляция). В результат!» vn-ялявтея большое количество СО) и. соответственно, водородных попов (1Г),
Оксигемоглобин
Рис. 2.12. Химические реакции, протекающие в эритроцитах при газообмене в легких. (По Р. Шмидту и Г. Ревсу с соавт.,1996, в модификации)
благодаря чему рН возвращается к исходному уровню. Наоборот, увеличение содержания ОСНОВАНИЙ (метаболический нереспираторный алкалоз) сопровождается уменьшением интенсивности вентиляции (гиповентиляцией), давление С02 и концентрация попои 1Г возрастают, а сдвиг рН в щелочную сторону компенсируется.
3. Роль почек. Третьим регулятором кислотно-основного состояния являются почки, коюрые удаляют из организма ионы Н' и реабсорбируют бикарбонат натрия (NaHC03). Эти важные процессы осуществляются преимущественно в почечных канальцах. При ЭТОМ используются три основных механизма:
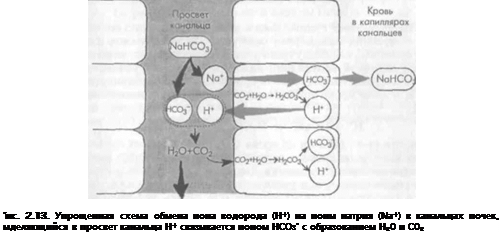
Обмен ионов водорода на ионы натрия (рис. 2.13). В основе этого процесса лежит и 11 тируемая карбоангидразой реакция: С02+ Н20 = Н2СОз; образующаяся углекислота (112СОз) диссоциирует па ионы Н+ и НСОз". Ионы выделяются в просвет канальцев, а на их место из канальцевой жидкости поступает эквивалентное количество ионов натрия (Na+). В результате организм освобождается от водородных ионов и в то же время восполняет запасы бикарбоната натрия (Nal-ЮОз), который реабсорбируется в интер-(•тпциальиую ткань почки и попадает в кровь.
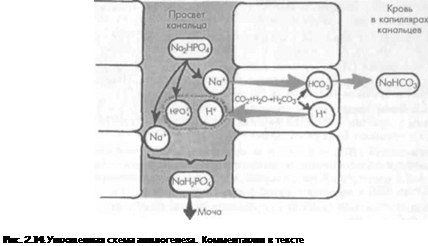
ЛцшЬгенез (рис. 2.14). Аналогичным образом происходит обмен ИОВОВ //' па попы Na* с участием двухосновного фосфата. Выделяющиеся в просвет канальца водородные ноны связываются анионом НРО42- с образованием одноосновного фосфата натрия (ЫаНгРО^). Одновременно эквивалентное количество ионов Na+ поступает в эпитедп альиую клетку канальца и связывается с ионом НСОз" с образованием бикарбоната Na ' (№НСОз). Последний реабсорбируется и поступает в общий кровоток.
Ашишшогенез (рис. 2.15) осуществляется в дистальиых почечных канальцах, где из глютамииа и других аминокислот образуется аммиак. Последний нейтрализует IIОI мочи и связывает водородные ионы с образованием NH+ и CI-. Реабсорбирующийся натрий в соединении с ионом НСОз" также образует бикарбонат натрия (ЫаНСОз).
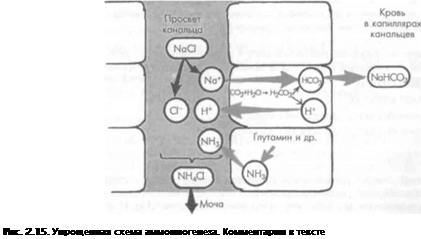
Таким образом, в канальцевой жидкости большая часть ионов Н+, поступающих па эпителия канальцев, связывается с ионами НСОз-, НРО42- и выводится с мочой. Одновременно происходит поступление эквивалентного количества ионов натрия в клетки канальцев с образованием бикарбоната натрия (ЫаНСОз), который реабсорбируется в канальцах и восполняет щелочной компонент бикарбонатпого буфера.
 2015-05-06
2015-05-06 607
607








