Рассмотрим N молекул газа находящихся в состоянии равновесия в сосуде объема V, при этом их концентрация n = N/V. Давление газа определяется суммой нормальных составляющих всех сил, с которыми действуют отдельные молекулы на единичную площадь стенки.
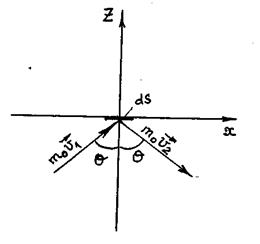
Р и с. 9
Для вычисления этого давления возьмем на стенке сосуда площадку dS и направим ось Z перпендикулярно ей, так что эта площадка будет лежать в плоскости XOY, перпендикулярной плоскости рис.9. Пусть некоторая молекула падает на площадку dS под углом θ к оси Z. При упругом ударе молекула зеркально (θ1= θ2) отразится от площадки dS, сохраняя величину скорости
υ неизменной (υ1 = υ2 = υ). При этом изменение импульса молекулы
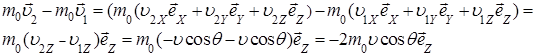
(1.5.1)
где m0 - масса молекулы, 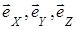 - единичные векторы координатных осей.
- единичные векторы координатных осей.
Из выражения (1.5.1) видно, что вектор изменения импульса молекулы перпендикулярен площадке dS и по второму закону Ньютона равен импульсу силы, действующей со стороны стенки на молекулу, т.е.
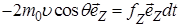 (1.5.2)
(1.5.2)
По третьему закону Ньютона сила 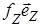 , действующая со стороны стенки на молекулу, равна по величине и противоположна
, действующая со стороны стенки на молекулу, равна по величине и противоположна
по направлению силе – 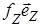 , с которой молекула действует на
, с которой молекула действует на
стенку. С учетом этого равенство (1.5.2) примет вид:
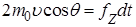 (1.5.3)
(1.5.3)
Чтобы найти число молекул, ударяющихся о площадку dS за время dt под углами от θ до θ + dθ и имеющих скорости от υ до υ + dυ, очевидно, необходимо проинтегрировать соотношение (1.4.3) предыдущего параграфа по всем возможным углам φ (от φ = 0 до φ = 2π), т.е.
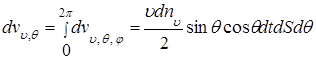 (1.5.4)
(1.5.4)
Эти молекулы сообщают площадке dS за время dt импульс силы
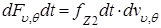 (1.5.5)
(1.5.5)
Подставляя из выражений (1.5.3) и (1.5.4) величины 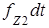 и
и 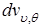 , имеем
, имеем
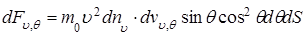 (1.5.6)
(1.5.6)
Чтобы учесть все молекулы, ударяющиеся о площадку dS с различными скоростями υ и под различными углами θ, необходимо последнее соотношение проинтегрировать по υ от нуля до υmax и по θ от нуля до π/2, т.е.
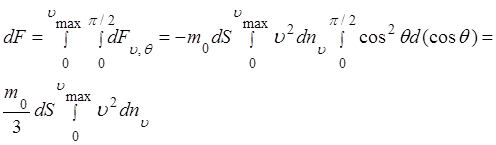 (1.5.7)
(1.5.7)
Разделив обе части равенства (1.5.7) на площадь dS, получим выражение для давления, производимого газом на стенку сосуда
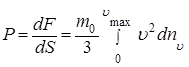 (1.5.8)
(1.5.8)
Вводя в правую часть выражения (1.5.8) постоянную величину, равную концентрации n молекул в сосуде, получим
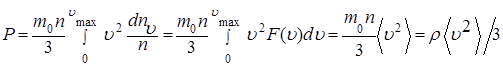 (1.5.9)
(1.5.9)
где ρ - плотность газа, а 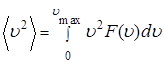 - средний квадрат скорости молекулы газа (см. 4.29 Приложения А). Формуле (1.5.9) можно придать следующий вид:
- средний квадрат скорости молекулы газа (см. 4.29 Приложения А). Формуле (1.5.9) можно придать следующий вид:
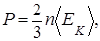 (1.5.11)
(1.5.11)
где 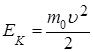 - кинетическая энергия поступательного движения молекулы, среднее значение которой
- кинетическая энергия поступательного движения молекулы, среднее значение которой
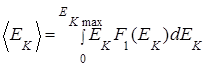 (1.5.12)
(1.5.12)
Функция распределения по кинетическим энергиям 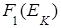 связана с функцией
связана с функцией 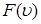 по скоростям молекул соотношением (см. () Приложения А)
по скоростям молекул соотношением (см. () Приложения А)
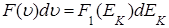 (1.5.13)
(1.5.13)
Таким образом, давление (1.5.11), создаваемое молекулами газа, равно двум третям средней кинетической энергии поступательного движения всех молекул, имеющихся в единичном объеме.
Как видно из выражений (1.5.9) и (1.5.11), давление P зависит от вида функции распределения 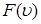 (или
(или 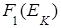 )
)
Нахождение функций распределения равновесных (и неравновесных) состояний системы частиц является основной задачей статистической физики. Явный вид функции 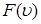 для равновесного состояния газа будет найден в дальнейшем.
для равновесного состояния газа будет найден в дальнейшем.
 2015-04-20
2015-04-20 811
811








