Реакции альдольной конденсации могут быть представлены стехиометрическим уравнением
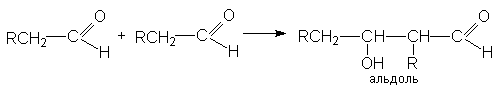
Реакция катализируется основаниями и кислотами. Механизм основно-каталитической альдольной конденсации может быть представлен следующими стадиями
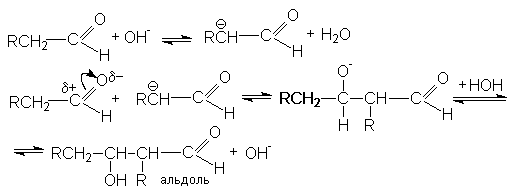
При нагревании образующийся продукт легко дегидрируется, образуя a,b -ненасыщенные альдегиды
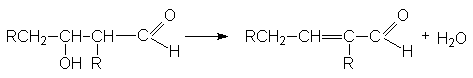
Стадия дегидратации протекает сравнительно легко благодаря двум причинам: 1) кислому характеру атома водорода при a -углеродном атоме, 2) образованию стабильной системы сопряженных двойных связей.
Механизм кислотно-каталитической альдольной конденсации может быть представлен стадиями:
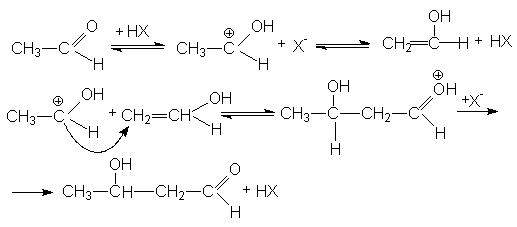
Присутствие кислоты - катализатора является дополнительным фактором дегидратации альдоля. Поэтому кислотно-каталитическую реакцию практически невозможно остановить на стадии образования альдоля (b -оксиальдегидами).
Альдольная конденсация двух различных альдегидов называется перекрестной альдольной конденсацией. Проводить перекрестную альдольную конденсацию двух альдегидов, содержащих водородные атомы при a -углеродных атомах не имеет смысла, так как в результате такого синтеза получается смесь продуктов перекрестной конденсации и автоконденсации.
Альдольную конденсацию двух различных карбонильных соединений можно осуществить, если на одно из них, не содержащее водородные атомы при a -углероде и взятое в избытке, воздействовать другим, в структуре которого имеются водородные атомы при a -углероде. Примером может служить конденсация формальдегида с уксусным ангидридом
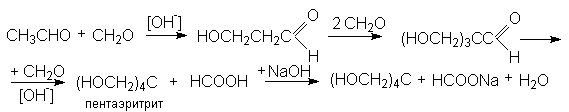
Получающийся многоатомный спирт, пентаэритрит, используется в качестве исходного вещества для получения полиэфирных смол.
Поскольку кетоны гораздо более инертны к нуклеофильной атаке, то их можно использовать в перекрестных реакциях конденсации с альдегидами, не содержащими подвижные атомы водорода при a -углеродном атоме. При этом реакцию необходимо проводить в условиях, неблагоприятных для кетон-кетонной конденсации. В частности, концентрация кетона в реакционной смеси должна быть низкой.
Вариантом перекрестной альдольной конденсации можно считать реакцию Кнёвенагеля. В отличии от обычной альдольной конденсации здесь в качестве метиленовой компоненты используются соединения, содержащие при метиленовой группе две карбонильные группы или другие сильные электроакцепторные группы. Кислотность водородных атомов в этой метиленовой группе существенно выше чем у обычных соединений, что и обусловливает ее функцию метиленовой компоненты. Типичным примером этой реакции является взаимодействие альдегидов с малоновым эфиром:
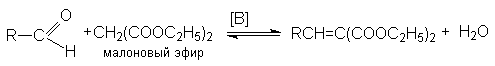
Механизм этой реакции реализуется через следующие стадии:
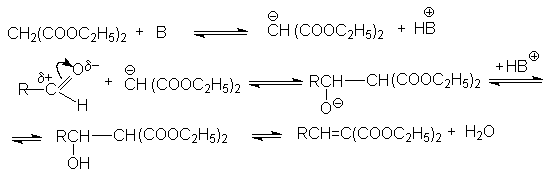
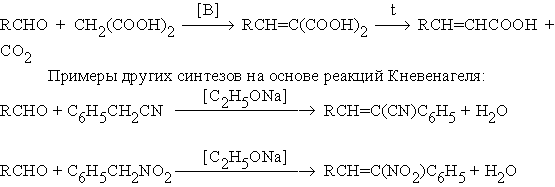
Смещение равновесия в этой реакции является отгонка воды из реакционной массы. Если в качестве метиленовой компоненты использовать малоновую кислоту, то открывается возможность синтеза a,b -ненасыщенных кислот:
Альдольная конденсация кетонов
Кетоны значительно труднее вступают в реакции альдольной автоконденсации по сравнению с альдегидами. Структурные условия здесь неблагоприятны как с точки зрения скорости, так и сточки зрения равновесия. Однако если реакцию проводить при кислотном катализе, то образующийся продукт конденсации будет быстро дегидратироваться, превращаясь в мезитилоксид. Эта последняя стадия смещает равновесие в сторону полного превращения кетона
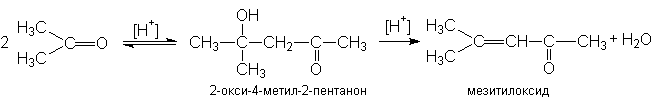
 2015-04-23
2015-04-23 8941
8941








