Стехиометрия реакций нуклеофильного присоединения реагента:NuH к карбонильному соединению представляется следующим уравнением
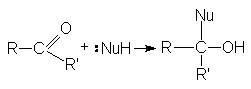
Как указывалось выше, атака нуклеофильного реагента на карбонильный атом углерода приводит к разрыву p -связи карбонильной группы. Образующийся при этом интермедиат претерпевает дальнейшие превращения, приводящие к образованию продуктов нуклеофильного присоединения.
Реакции нуклеофильного присоединения по карбонильной группе могут осуществляться при кислотном, основном катализе или некаталитически.
В некаталитической реакции реализуется механизм:
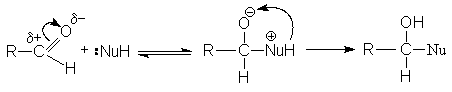
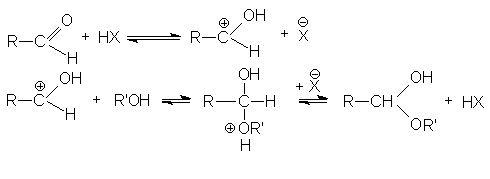
В случае кислотного катализа собственно нуклеофильной атаке предшествует протонирование субстрата:
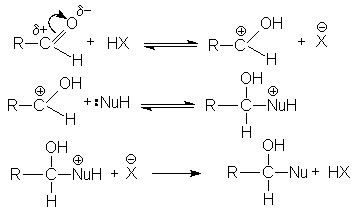
При основном катализе функция катализатора заключается в генерировании за счет кислотно-основного взаимодействия с реагентом более сильного нуклеофила, успешно атакующего карбонильный углерод:
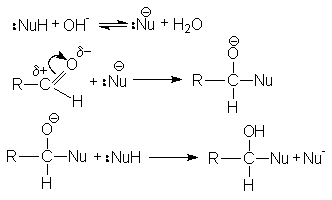
Примерами реакций нуклеофильного присоединения, реализуемых по одному из вышеприведенных механизмов являются:
1. Кислотно-каталитическая реакция образования ацеталей и полуацеталей
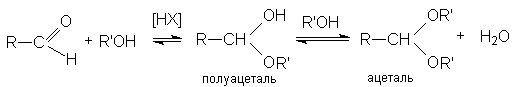
Механизм образования полуацеталей согласуется с общим механизмом кислотно-каталитического нуклеофильного присоединения по карбонильной группе
Вторичная реакция образования ацеталей является типичной кислотно-каталитической реакцией образования простого эфира
2. Образование гидратов альдегидов.
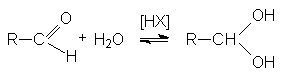
Механизм этой реакции подобен механизму образования полуацеталей. Положение равновесия зависит от структуры альдегидов и условий реакции.
3. Взаимодействие с гидросульфитом (бисульфитом) натрия
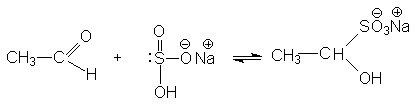
Катализатор в этой реакции не требуется, так как гидросульфит – анион в ионной паре соли является достаточно эффективным нуклеофильным агентом.
Продукты присоединения гидросульфита с карбонильным соединением – хорошо кристаллизующиеся вещества, нерастворимые в водном растворе гидросульфита натрия. Поэтому их используют для отделения карбонильных соединений от веществ, с которыми гидросульфит натрия не вступает в реакции. При нагревании с раствором соды или щелочей полученные аддукты разлагаются с образованием сульфита натрия и регенерацией карбонильного соединения.
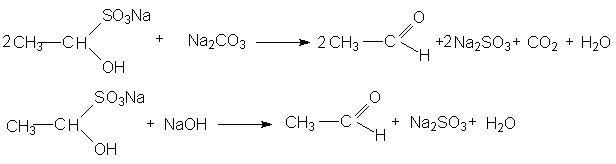
Следует отметить, что в реакцию с гидросульфитом натрия вступают только альдегиды и метилкетоны.
4. Замещение кислорода карбонильной группы на галогены.
Галогенирующими агентами по отношению к альдегидам и кетонам выступают галогениды фосфора, серы и др.
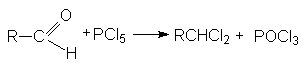
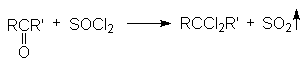
При взаимодействии с этими реагентами, которые являются сильными электрофилами, происходит активация карбонильного соединения, сопровождающаяся нуклеофильной атакой галогенид–аниона на карбонильный углерод
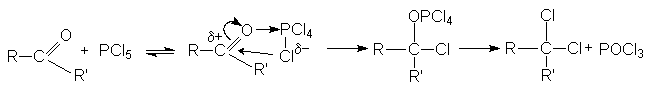
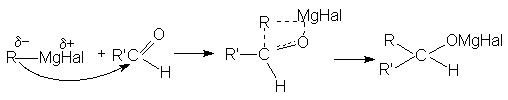
5. Взаимодействие с реактивами Гриньяра
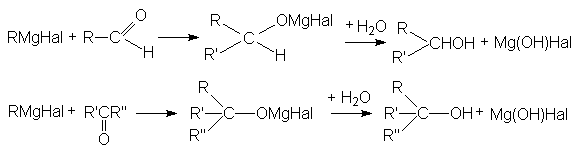
Поскольку в молекуле реактива Гриньяра углеводородный радикал имеет карбанионный характер, то он выступает в роли нуклеофильного агента по отношениюк карбонильному углероду субстрата
6. Образование циангидринов
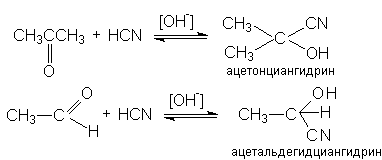
В этих реакциях роль основного катализа заключается в галогенировании эффективного нуклеофила:
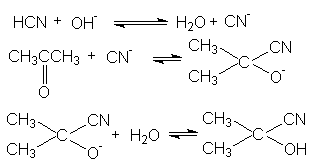
Продукты реакции, циангидрины, имеют практическое значение, связанное с получением мономеров для производства синтетических волокон и пластмасс – метакрилонитрила, метакриламида, метилметакрилата, акрилонитрила, акриламида, метилакрилата
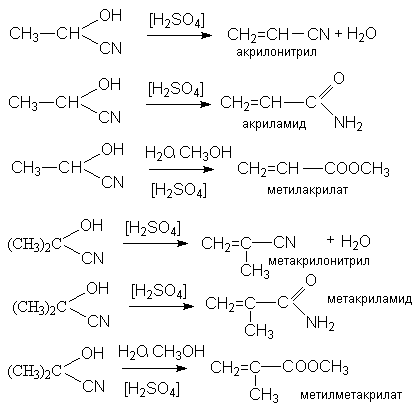
7. Реакции нуклеофильного присоединения азотистых оснований.
К этим реакциям относятся:
а) образование иминов (азометинов) – оснований Шиффа
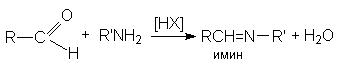
б) образование оксимов
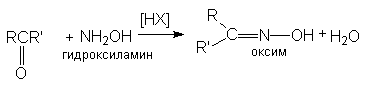
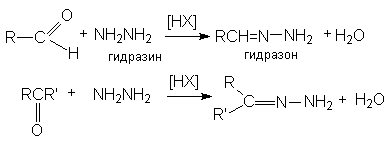
в) образование гидразонов
г) синтез семикарбазонов
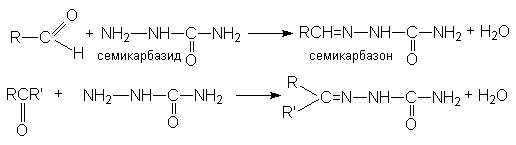
Все эти реакции протекают по единому механизму, причем кислотный катализ не только ускоряет первичный акт нуклеофильного присоединения, но и способствует эффективному отщеплению воды на последующих стадиях. Обозначив азотистое основание NH2X, можно представить общий механизм их взаимодействия с карбонильными соединениями при катализе кислотой HY:
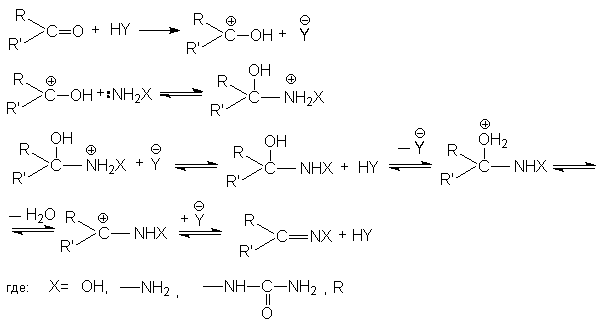
Реакционная способность карбонильных соединений
в реакциях нуклеофильного присоединения
Скорость-определяющей стадией реакций нуклеофильного присоединения по карбонильной группе является бимолекулярная атака реакционного центра субстрата нуклеофилом. Поэтому успех реакции определяется величиной частичного положительного заряда на карбонильном углероде и его пространственной доступностью. Поэтому реакционная способность карбонильных соединений падает по мере увеличения длины и разветвленности алкильного радикала при карбонильном углероде, а также при переходе от альдегидов к кетонам:
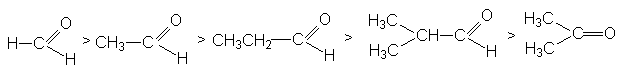
Можно видеть, что такое влияние связано с увеличением в этом ряду положительного индуктивного эффекта алкильных групп и с возрастанием пространственных препятствий для атаки на карбонильный углерод.
 2015-04-23
2015-04-23 8728
8728








