В расчетах процессов химической технологии обычно используется система координат Эйлера, т.е. система координат, фиксированная относительно некоторого неподвижного объема пространства, через который протекает материальная среда. Такой объем называют контрольным, а поверхность, ограничивающую контрольный объем, именуют контрольной.
Выделим на контрольной поверхности S элементарную площадку dS и восста
новим к ней нормаль n (см. рис. 7.1).
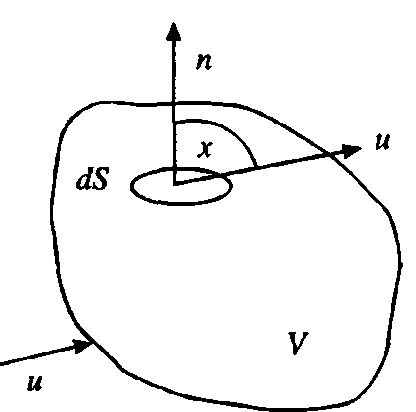 Рис. 7.1 Контрольная поверхность Рис. 7.1 Контрольная поверхность | Тогда интегральное уравнение баланса мас- сы (при отсутствии процессов диффузионного переноса) будет иметь вид 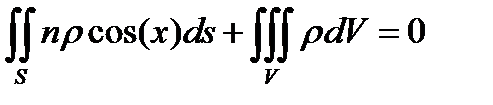 где р - плотность; τ - время; х – угол между вектором скорости и нормалью к контрольной поверхности S. Первый интеграл в уравнении характеризует где р - плотность; τ - время; х – угол между вектором скорости и нормалью к контрольной поверхности S. Первый интеграл в уравнении характеризует |
расход вещества через контрольную поверхность, а второй - скорость накопления вещества в контрольном объёме. Для химических аппаратов можно полагать, что вектор скорости потока перпендикулярен контрольной поверхности в точках входа и выхода и параллелен ей в остальных точках, поэтому это уравнение можно проинтегрировать:
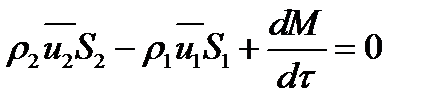
Два первых слагаемых в уравнении есть разность потоков на выходе и входе в аппарат, а третье - скорость накопления вещества в аппарате. Средняя скорость потока 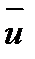 определяется выражением (по теореме о среднем)
определяется выражением (по теореме о среднем)
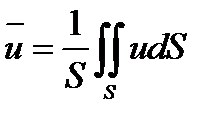
Если определить массовый расход как 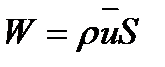 , то предпоследнее уравнение при-
, то предпоследнее уравнение при-
мет вид
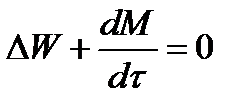
Для стационарного процесса
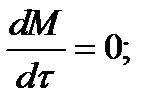 ∆W = 0; W1 = W2;
∆W = 0; W1 = W2;
Все эти уравнения являются балансом массы по всему веществу, проходящему че-
рез контрольный объем. Уравнение баланса массы по компоненту в такой же фор-
ме можно записать так:
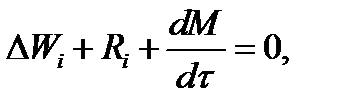
где Ri - скорость образования или расходования компонента i за счет химической реакции.
Последнее уравнение получено в предположении отсутствия диффузионных потоков. Его можно записать для каждого компонента системы. В сумме они дадут уравнение баланса массы по всему веществу, так как 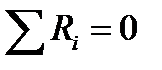 .
.
Таким образом, для n-компонентной системы можно составить n уравнений, причем одно уравнение общего баланса массы и (n - 1) уравнение балансов массы по компонентам смеси.
При отсутствии химических реакций уравнение общего баланса массы можно записать в мольных расходах:
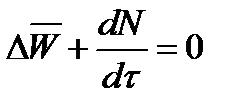
При наличии химического взаимодействия уравнение в мольных расходах по ком-
поненту примет вид
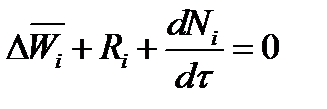
где Ni — число молей компонента.
Суммирование последнего уравнения по всем компонентам дает
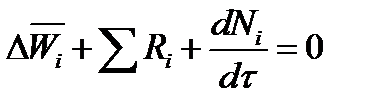
В обшем случае сумма скоростей превращения компонентов 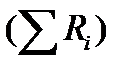 не всегда равна нулю, так как число молей в процессе реакции может изменяться. Рассмотрим пример применения уравнения материального баланса к нестационарному процессу
не всегда равна нулю, так как число молей в процессе реакции может изменяться. Рассмотрим пример применения уравнения материального баланса к нестационарному процессу
Пример 7.3. При упрощенном способе производства Н3РO4 в хорошо перемешива-
емую емкость, где реагирует 4000 кг/ч взвешенного в воде Са3(РO4)2, подается стехиометрическое количество 94%-ной серной кислоты. Вместе с фосфоритной мукой подается вода в количестве, достаточном для получения при стационарном ходе процесса 40%-ной фосфорной кислоты. Образующиеся раствор фосфорной кислоты и гипс (СаSO4∙2Н2O) равномерно удаляются из смесителя так что общая масса в нем остается постоянной. Какова будет концентрация раствора фосфорной кислоты в емкости по истечении 1 часа работы, если процесс начался, когда в емкости находилось 4000 кг 20%-ной фосфорной кислоты?
Решение: Запишем уравнение реакции и проведем стехиометрические расчеты в предположении полного превращения фосфорита:
Са3(РO4)2 + 3Н2SO4 + 6Н2O = 2Н3РO4 + 3(СаSO4∙2Н2О).
Или в буквенном выражении:
- А - 3С - 6В + 2F + 3G = 0.
Молекулярные массы компонентов реакции в кг/кмоль: MA = 310,18;
MC = 98,07; МB = 18,02; МF = 98,00; МG = 172,17.
Определим коэффициент расхода по фосфориту
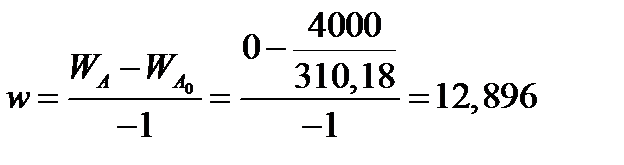
Тогда расходы компонентов будут равны (кг/ч):
WC0=WC – w (-3) MC = 0- 12,896 ∙ (-3) 98,07 = 3794,1;
WB0= 0 - 12,896 ∙ (-6) 18, 02 = 1394, 3;
WF = WF0 + 2МF = 0 + 12,896 ∙2 ∙98, 00 = 2527, 6;
WC = 0+ 12,896 ∙3 ∙172, 17 = 6660, 92.
Определим количество воды, подаваемой с фосфоритной мукой.
Составим баланс по воде
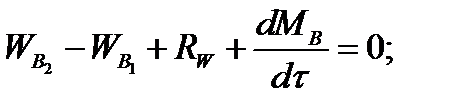
По условию задачи dMB/dτ = 0. Расход воды, уходяшей с фосфорной кислотой
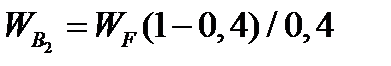 = 2527,6 ∙(1 - 0,4)/0,4= 3791,4 кг/ч.
= 2527,6 ∙(1 - 0,4)/0,4= 3791,4 кг/ч.
Расход воды, приносимой с серной кислотой
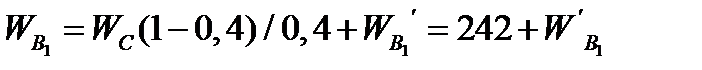 ,кг/ч.
,кг/ч.
Скорость образования воды по химической реакции
RW =WB0 = 1394, 3 кг/ч.
Тогда расход воды, подаваемой с фосфоритной мукой
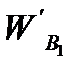 = 3791,4 + 1394,3 - 242 = 4943,7 кг/ч.
= 3791,4 + 1394,3 - 242 = 4943,7 кг/ч.
Составим баланс по фосфорной кислоте:
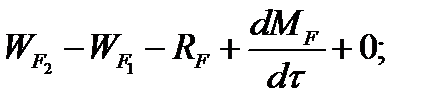
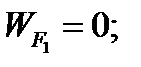
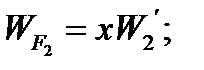 RF = WF = 2527, 6 кг/ч
RF = WF = 2527, 6 кг/ч
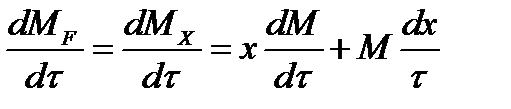
где х - концентрация фосфорной кислоты на выходе из емкости и в самой емкости; М - общее количество реакционной смеси, кг.
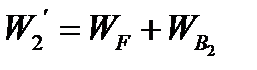 = 2527,6 + 3791,4 = 6319 кг/ч.
= 2527,6 + 3791,4 = 6319 кг/ч.
Для определения общего количества реакционной смеси (М) составим уравнение баланса по всему веществу:
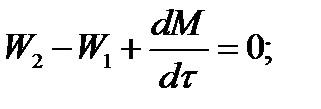 W2 = W1; dM/dτ = 0; dM = 0; M = M0
W2 = W1; dM/dτ = 0; dM = 0; M = M0
где М0 — начальное количество вещества в емкости; М0 = 4000 кг.
Тогда
6319х - 2527,6 + 4000 (dx/dτ) = 0.
После разделения переменных
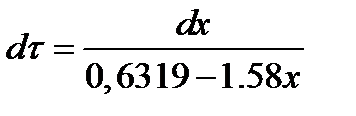
Проинтегрируем полученное уравнение в пределах от 0 до τ и от 0,2 до х. После преобразований получим
х=0,4 - 0,2ехр(-1,580τ).
За время 1 час концентрация фосфорной кислоты станет равной
х = 0,4 - 0,2ехр(-1,580) = 0,3588 или 35,88%.
Проверка физического смысла полученного решения дает:
при τ → ∞ х → 0,4.
 2015-04-30
2015-04-30 4585
4585