Клиническая характеристика ОЛЛ у детей
Интоксикационный синдром проявляется астенией, лихорадкой, потерей массы тела у детей раннего возраста. Дисфункция костного мозга проявляется всеми типичными синдромами. Инфильтрация печени и селезенки может проявляться болями в животе, тошнотой, анорексией. Лейкемическая инфильтрация, инфаркты костей вызывают боли в костях, переломы трубчатых костей или позвоночника. Увеличение яичек у мальчиков отмечается в 5–30% случаев ОЛЛ. Центральная нервная система обычно вовлекается при рецидивах заболевания после химиотерапии.
Лечение выстраивается в зависимости от возраста, иммунофенотипа бластных клеток, раннего ответа на терапию, генотипических характеристик лейкемических клеток и кинетики исчезновения остаточной опухолевой популяции.
Хронический лимфолейкоз -второй по частоте лейкоз,встречается в пожилом возрасте, у мужчин в два раза чаще. Содержание лимфоцитов в крови доходит до 80% - 99%, увеличиваются лимфатические узлы, печень и селезенка. Иногда масса селезенки составляет несколько килограммов.
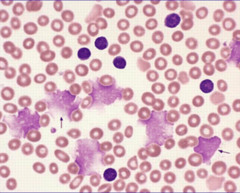 Заболевание протекает длительно с высокими показателями выживаемости. Клетки аномального клона являются зрелыми лимфоцитами, в основном В-лимфоцитами (приблизительно в 95% случаев), реже Т-лимфоцитами. Функциональная неполноценность лимфоцитов приводит к возникновению у больных инфекционных и аутоиммунных осложнений (анемия, тромбоцитемия). Т-клеточные формы имеют более агрессивное течение.
Заболевание протекает длительно с высокими показателями выживаемости. Клетки аномального клона являются зрелыми лимфоцитами, в основном В-лимфоцитами (приблизительно в 95% случаев), реже Т-лимфоцитами. Функциональная неполноценность лимфоцитов приводит к возникновению у больных инфекционных и аутоиммунных осложнений (анемия, тромбоцитемия). Т-клеточные формы имеют более агрессивное течение.
Характерно присутствие в мазках крови разрушенных лимфоцитов - так называемых клеточных теней (тени Боткина-Гумпрехта).

 На ранних стадиях лечение не проводится. Многие пациенты ведут нормальную и активную жизнь годами.
На ранних стадиях лечение не проводится. Многие пациенты ведут нормальную и активную жизнь годами.
Лечение начинают в той стадии, когда заболевание может повлиять на качество жизни пациента. Применяется химиотерапия, радиотерапия, иммунотерапия, трансплантация костного мозга. В настоящее время лейкоз считается неизлечимым.
Существует группа редких опухолей, основным проявлением которых служит лимфоцитоз. К ним относится и волосатоклеточный лейкоз - B-клеточное новообразование низкой степени злокачественности. Клетки покрыты ворсинками, похожими на волосы. 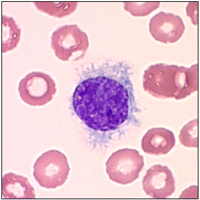 Клинические проявления варьируют от бессимптомного лимфоцитоза и спленомегалии до тяжелых инфекций, обусловленных резкой нейтропенией.
Клинические проявления варьируют от бессимптомного лимфоцитоза и спленомегалии до тяжелых инфекций, обусловленных резкой нейтропенией.
Аналоги пуринов, особенно кладрибин, совершили переворот в лечении этого заболевания. Частота полных ремиссий при лечении кладрибином превышает 80%, полная ремиссия нередко достигается уже после первого курса и часто длится более 3 лет.
Хронический миелолейкоз – лейкозный клон возникает из полипотентной стволовой клетки, поэтому в патологический процесс вовлечены клеточные элементы всех рядов гемопоэза. Ph-хромосома обнаруживается почти во всех делящихся клетках миелопоэза, а также в бластных клетках при лимфобластных кризах.
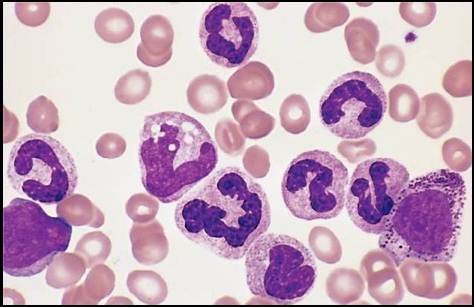 Пролиферирует в основном гранулоцитарный росток. Количество лейкоцитов в периферической крови от 20 до 500×109/л с гиперрегенеративным сдвигом влево. Если количество незрелых форм невелико, необходимо проводить дифференциальную диагностику с лейкемоидной реакцией миелоидного типа.
Пролиферирует в основном гранулоцитарный росток. Количество лейкоцитов в периферической крови от 20 до 500×109/л с гиперрегенеративным сдвигом влево. Если количество незрелых форм невелико, необходимо проводить дифференциальную диагностику с лейкемоидной реакцией миелоидного типа.
Дифференциальные признаки миелолейкоза: наличие Ph-хромосомы; увеличение содержания в крови базофилов и эозинофилов (базофильно-эозинофильная ассоциация), резкое снижение в лейкоцитах щелочной фосфатазы.
Лейкоз медленно прогрессирует, моноклоновая опухоль превращается в поликлоновую. В финальной фазе развивается так называемый бластный криз.
Лечение. Транслокация t(9;22) формирует ген bcr-abl, продуктом которого является тирозинкиназа. В конце 1990 годов начали применение ингибитора тирозинкиназ STI-571(imatinib, Gleevec). Он тормозит пролиферацию аномальных клеток. Ныне получены более мощные ингибиторы тирозинкиназ dasatinib и nilotinib, их применение кардинально изменило судьбу больных.
В клиническом плане хронический лимфолейкоз, промиелоцитарный лейкоз и волосатоклеточный лейкоз принято рассматривать как отдельные морфологические и клинико-патологические единицы, требующие различных терапевтических подходов.
Принципиальная возможность излечения большинства детей, больных острым лимфобластным лейкозом, - одно из наиболее ярких достижений последних десятилетий. Современное эффективное лечение хронического миелолейкоза, острого промиелоцитарного лейкоза требует пожизненного регулярного приема лекарств. Оно позволяет не только спасти людям жизнь, но и сохраняет их трудоспособность на продолжительное время.
Лейкемоидные реакции - патологические изменения состава крови, сходные с картиной крови при лейкозах. Вызывать лейкемоидные реакции могут вирусы, токсины тканевых гельминтов, продукты распада клеток крови (при гемолизе) и опухолей, сепсис и др. При этом происходит гиперплазия кроветворных клеток при нормальных соотношениях отдельных элементов в красном костном мозге.
Лейкемоидные реакции могут быть миелоидного, эозинофильного, лимфоидного, моноцитарного типа, к ним также относятся симптоматические эритроцитозы.
Лейкемоидные реакции миелоидного типа напоминают хронический миелолейкоз. Это наиболее частый тип лейкемоидных реакций. Причинами могут быть инфекции, шок, ионизирующее излучение, интоксикации (приём сульфаниламидных препаратов, лечение глюкокортикоидами, уремия, отравление угарным газом). В периферической крови выявляют умеренный лейкоцитоз с гиперрегенераторным сдвигом нейтрофильного ядра влево, с токсической зернистостью и дегенеративными изменениями нейтрофильных гранулоцитов. Миелограмма характеризуется увеличением содержания молодых клеток нейтрофильного ряда, с преобладанием более зрелых элементов (миелоцитов, метамиелоцитов). Активность щелочной фосфатазы в нейтрофилах повышена.
Л ейкемоидные реакции эозинофильного типа. Причинами возникновения этого типа реакций служат в основном гельминтозы, реже коллагенозы, лимфогранулематоз, эндокринопатии. Характерен лейкоцитоз до 40-50×109/л, эозинофилия (60-90%) за счёт зрелых форм эозинофилов. Исследование костного мозга позволяет дифференцировать этот тип реакции с эозинофильным вариантом хронического миелолейкоза.
Лейкемоидные реакции лимфоидного и моноцитарного типа наблюдаются при инфекционном мононуклеозе- вирусном заболевании, проявляющемся изменениями крови, реактивным лимфаденитом и увеличением селезёнки. В периферической крови наблюдают лейкоцитоз до 10-30×109/л. Содержание лимфоцитов достигает 50-70%, моноцитов - 10-40%, появляются плазматические клетки, атипичные мононуклеары, патогномоничные для данного заболевания.
ПАТОЛОГИЯ СИСТЕМЫ ГЕМОСТАЗА
Система гемостаза выполняет в организме две важные функции: 1. собственно гемостаз – остановку кровотечения при повреждении сосуда; 2. поддержание жидкого состояния крови. Первую функцию называют гемостатической, вторую – антигемостатической.
Гемостаз достигается взаимодействием между стенкой сосуда (сосудистый компонент), тромбоцитами (тромбоцитарный или клеточный компонент) и белками крови, входящими в состав свертывающей, противосвертывающей и фибринолитической систем (плазменный или коагуляционный компонент).
Сосудистое звено (компонент) гемостаза. Спазм сосуда— самая ранняя реакция на повреждение, сначала рефлекторная, затем усиленная и продленная благодаря секреции тромбоцитами активных вазоконстрикторов: тромбоксанаА2 (ТХА2), серотонина и эндотелина-1, вырабатываемого эндотелием. Все компоненты сосудистой стенки участвуют в реакции на травму, особенно важную роль в гемостазе играет эндотелий. Эндотелиальные клетки вырабатывают компоненты базальной мембраны; коллаген; белки, необходимые для прилипания тромбоцитов к коллагену, вещества, которые секретируются в кровь и регулируют текучесть крови. Кроме того, они продуцируют вещества, расширяющие сосуды и препятствующие адгезии и агрегации тромбоцитов: простациклин (ПГ I2) и монооксид азота (NO). В месте повреждения эндотелиоциты вырабатывают сосудосуживающий фактор эдотелин-1, а продукция ими простагландина ПГ I2 и NO уменьшается. Фактор Виллебранда (ФВ) синтезируется практически только в эндотелиоцитах, его продукция возрастает при повреждении эндотелия, вследствие чего этот фактор используется в качестве маркера повреждения эндотелия.
Вне повреждения эндотелий является антигемостатической, антитромботической поверхностью, а после травмы превращается в гемостатическую поверхность, фиксирующую тромбоциты и факторы свертывания, секретирующую в кровь множество активных веществ.
Клеточное звено системы гемостаза. Тромбоциты образуются в костном мозге в результате фрагментации мегакариоцитов. Они имеют форму дисков диаметром 2-5 мкм. Их число в крови здорового человека составляет 180 – 320 х 109/л.
 Тромбоцитам принадлежит ведущая роль в первичной остановке кровотечений из микрососудов. Тромбоциты циркулируют в кровотоке, не взаимодействуя друг с другом и с эндотелием сосудов. При нарушении целостности сосуда они накапливаются в местах повреждения и формируют так называемый белый или тромбоцитарный тромб. Такой тромб впоследствии закрепляется нитями фибрина, которые образуются в результате активации свертывающей системы. Так формируется полноценная гемостатическая пробка и происходит остановка кровотечения.
Тромбоцитам принадлежит ведущая роль в первичной остановке кровотечений из микрососудов. Тромбоциты циркулируют в кровотоке, не взаимодействуя друг с другом и с эндотелием сосудов. При нарушении целостности сосуда они накапливаются в местах повреждения и формируют так называемый белый или тромбоцитарный тромб. Такой тромб впоследствии закрепляется нитями фибрина, которые образуются в результате активации свертывающей системы. Так формируется полноценная гемостатическая пробка и происходит остановка кровотечения.
Стадия адгезии - при повреждении сосудистой стенки обнажаются компоненты, расположенные под эндотелием, способные вызвать прилипание тромбоцитов, их активацию. На волокнах коллагена фиксируются молекулы фактора Виллебранда (ФВ) и к ним, в свою очередь, прикрепляются тромбоциты. Процессы прикрепления клеток друг к другу называют термином "клеточная адгезия". Она обеспечивается специальными клеточными рецепторами, мембранными гликопротеидами, получившими название молекул клеточной адгезии. Гликопротеиды (ГП) тромбоцитов обеспечивают протекание начальных стадий процесса тромбообразования. Это так называемый первичный гемостаз — обратимый процесс, на который не распространяется действие гепарина. В начальной стадии адгезии тромбоцитарный гликопротеид ГП 1b взаимодействует с фактором Виллебранда, фиксированным на коллагене, а гликопротеид ГП 1a – непосредственно с коллагеном. Позднее процесс адгезии усиливает гликопротеидный комплекс, появляющийся на мембранах тромбоцитов в результате их активации - ГП IIb-IIIa.
Взаимодействие тромбоцитов с коллагеном, ФВ и тромбином приводит к их активации.
В результате активации происходит ряд важных процессов: секреция множества активных веществ; изменение формы тромбоцита; транспорт на мембрану тромбоцитов фосфолипидов, обеспечивающих каталитическую поверхность для активированных IX и Х факторов свертывания; транспорт на поверхность тромбоцитов Р-селектина, обеспечивающего фиксацию лейкоцитов в зоне повреждения; сокращение (ретракция) тромба.
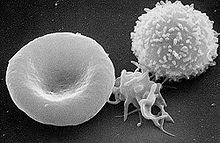
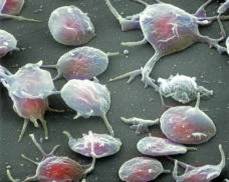
Сканирующая электронограмма. Слева направо: эритроцит, активированный тромбоцит, лейкоцит.
Самое раннее из этих событий – дегрануляция и секреция АДФ. Кроме того, из липидного слоя мембраны освобождается арахидоновая кислота, которая под влиянием фермента циклооксигеназы превращается в простагландины, затем под влиянием тромбоксансинтетазы – в тромбоксан А2 (ТхА2). ТхА2 – мощный стимулятор тромбоцитов, вовлекает новые порции тромбоцитов в процесс агрегации. Ингибиторы циклооксигеназы, такие как аспирин, блокируя синтез ТхА2, ингибируют агрегацию тромбоцитов. ТхА2 , АДФ и тромбин (он чуть позднее появляется в процессе свертывания крови) – агреганты. Агреганты изменяют конформацию гликопротеидного комплекса ГП IIb-IIIa, он становится рецептором фибриногена, обеспечивая склеивание тромбоцитов.
Агрегация тромбоцитов. Ключевая роль в процессе агрегации тромбоцитов принадлежит комплексу гликопротеидов IIb-IIIa. Он приобретает способность к связыванию фибриногена только при активации тромбоцитов. Фибриноген, взаимодействуя одновременно с двумя молекулами гликопротеида IIb-IIIa, образует молекулярные "мостики" между тромбоцитами, обеспечивая их склеивание. Сначала связь между тромбоцитами непрочная – это обратимая агрегация, затем изменение формы тромбоцитов, состояния их цитоплазмы обеспечивают необратимую агрегацию.
Активированные тромбоциты на протяжении всего процесса тромбообразования секретируют содержимое гранул через систему открытых каналов - стадия секреции. Тромбоциты имеют три типа гранул: α-гранулы, плотные гранулы и лизосомы. Плотные гранулы содержат АДФ, АТФ, серотонин, пирофосфат, ионы Са2+; α-гранулы – тромбоцитарный фактор роста, трансформирующий фактор роста β1, ß-тромбоглобулин, фактор VIII, антиген фактора Виллебранда, фактор V, фибриноген, тромбоспондин, фибронектин; лизосомальные гранулы - фосфатазы, арилсульфатазы, кислые гидролазы.
Образование тромба – лишь временное решение проблемы остановки кровотечения, необходимо восстановление поврежденного сосуда. Тромбоциты помогают этому, секретируя факторы роста, стимулирующие рост сосудов; хемоаттрактанты, привлекающие к месту повреждения фибробласты из окружающей ткани.
 2015-05-14
2015-05-14 1395
1395








