| Дано: Уравнение реакции | Решение Записываем реакцию в ионном виде: |
| Кс –? |
Feo(к) + Cu+2(р-р) + SO 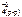 <=> Fe+2(р-р) + SO
<=> Fe+2(р-р) + SO 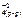 + Cuo(к)
+ Cuo(к)
Полное ионное уравнение.
Cu+2(р-р) + Feo(к) < = > Fe+2(р-р) + Cu0(к) – сокращенное ионное уравнение
НОК ДМ
окис-ль Сu+2 + 2ē = Cu 1 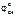 = 0,34 В (см. табл. 11.1)
= 0,34 В (см. табл. 11.1)
восст-ль Fe0 – 2ē = Fe+2 1 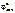 = –0,44 В (см. табл. 11.1)
= –0,44 В (см. табл. 11.1)
Cu+2 + Fe0 = Cu0 + Fe+2
ε0 = 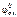 –
– 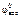 ; ε0 = 0,34 – (–0,44) = 0,78 В.
; ε0 = 0,34 – (–0,44) = 0,78 В.
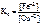 .
.
Так как приведенная реакция является окислительно-восстанови-тельной, то
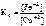 =
= 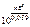 ,
,
где n – НОК.
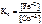 =
= 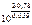 = 1026
= 1026
Высокое значение Кс свидетельствует о прктически полном смещении равновесия вправо.
Ответ: Кс = 1026
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
УРОВЕНЬ В
Определить заряд комплексного иона, степень окисления и координационное число комплексообразователя в каждом из соединений
K4[Mo(CN)8], [PtCl4(NH3)2].
 2015-05-10
2015-05-10 318
318








