Как уже было сказано, не существует методов измерения абсолютных значений электродных потенциалов, поэтому определяют относительные стандартные потенциалы. Потенциал стандартного водородного электрода договорились считать равным нулю и все остальные электродные потенциалы определяют по отношению к нему. Обычно для измерения относительного электродного потенциала пользуются двумя полуэлементами - одним с электродом, потенциал которого измеряется С, и другим - с нормальным водородным электродом F (рис.3). Система из двух полуэлементов называется гальваническим элементом. Электродвижущая сила (ЭДС) Е гальванического элемента, равная разности потенциалов полуэлементов, определяется компенсационным методом. Полуэлементы присоединяются к цепи внешнего источника электричества (например, аккумулятора А) таким образом, чтобы положительный полюс аккумулятора был соединен с положительным полюсом исследуемого гальванического элемента элемента, а отрицательный полюс аккумулятора — с отрицательным полюсом гальванического элемента. Перемещая движок О, можно добиться того, что гальванометр О (очень чувствительный измеритель Ш силы тока) покажет отсутствие тока в цепи. По величине ЭДС аккумулятора, зная отношение сопротивлений HK и HD, можно определить ЭДС исследуемого гальванического элемента Е, Е=Е0Ме-Е0Н. Так как Е0Н=0, то Е°Ме-=Е. Для активных металлов Е°Ме имеет отрицательное значение, а для неактивных (медь, серебро, золото, платина) — положительное
Таблица 2
Стандартные окислительно-восстановительные потенциалы
Е0ов (20° С) для некоторых ионов.
| Восстановитель | - nе- | Окисленная форма | Е°, вольты |
| S+6ОН- | 4е- | S032-+ЗН20 | - 0,90 |
| S2+ | 2е- | Sтв. | -0,51 |
| NО+20Н- | 1е- | NО2 + Н2О. | - 0,46 |
| Рb + Н2S04 | 2е- | РbSО4+2Н + | - 0,36 - |
| Н202+20Н-. | 2е- | 02+2Н20 | - 0.08 |
| H2 | 2е- | 2Н + | ±0,00 |
| SO32-+Н20 | 2е- | ' SO42-.+ 2Н + | +0,20 |
| 40Н- | 4е- | О2+2Н20 | +0,40 |
| 2J- | 2е- | J2 | - +0,53 |
| Мn02 + 40Н- | Зе- | МпО4- + 2Н2О | +0,57 |
| Fe 2+ | 1е- | Fе 3+ | +0,77 |
| NO2 + Н20 | 1е- | NO3- +2H+ | +0,81 |
| NO+2Н20 | 3е- | NО3- + 4Н+ | +0,96 |
| NO+H2O | 1е- | NО2- + 2Н+ | +а,99 |
| 2Вг- | 2е- | Вr2 | - +1,07 |
| 4Н2О | 4е- | О2 + 4Н+ | + 1,23 |
| Мn2+ + +2Н2О | 2е- | Мп02 + 4Н+ | +1,28 |
| Сl2 + 2 Н2О | 2е- | 2СlO- + 4Н + | +1,36 |
| Рb2+ + 2 Н2О | 1е- | Рb02+4Н+ | +1,46 |
| 2Сг3+ + 7 Н20 | 6е- | Cr2O7+14H+ | +1,46 |
| 2С1- | 2е- | С12 | ,+1,52 |
| Мn2+ + 4 Н2O | 5е- | МпО4- + 8Н+ | +1,63 |
| Рb2+ +2 Н2O | 2е- | РЬO2 + 4Н+ | +1,68 |
| 2Н2O | 2е- | Н2O2 + 2Н+ | +1,77 |
| 02+Н2O | 2е- | 03 + 2Н+ | +2,07 |
| 2Р- | 2е- | F2 | +2,85 |
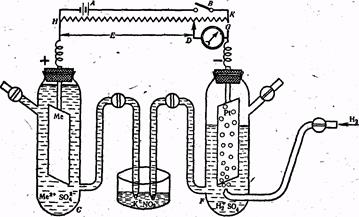
Рис. 3. Схема определения электродного потенциала
Для внешней цепи водородный электрод будет положительным полюсом, если в паре с ним находится электрод из активною металле; и отрицательным, если в царе с ним находится электрод из неактивного (благородного) металла. Следует напомнить, что электродные потенциалы согласно формуле Нернста меняются с изменением концентрации.
6. Теория гальванических элементов; явления поляризации и деполяризации
Первый гальванический элемент был создан итальянским физико -химиком А. Вольта. Он состоял из медных и цинковых пластинок, разделённых сукном, смоченным раствором серной кислоты. При последовательном соединении большого, числа пластинок элемент Вольта обладает значительной ЭДС. Схема элемента Вольта представлена на рис. 4.-
- 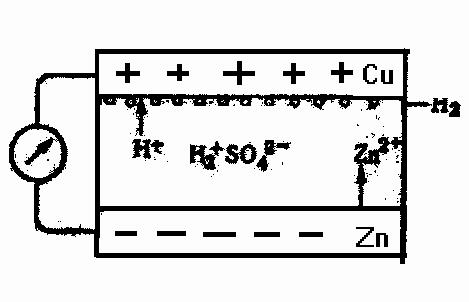
Рис. 4. Схема элемента Вольта
На поверхности раздела цинка и серной кислоты идет реакция:
Zn = Zn2++2e-
Электроны накапливаются на цинковом электроде и заряжают его отрицательно. Перемещаясь по внешней цепи к медному электроду, в котором концентрация электронов меньше, они обусловливают сле-
дующую реакцию:
2Н+ + 2е- = Н2
Суммарное уравнение реакции, за счет которой гальванический элемент Вольта дает электрический ток, выглядит так:
Zn + 2Н+ = Zn2++Н2
Медный электрод в элементе Вольта является инертным электродом и на границе с раствором серной кислоты играет роль водородного электрода
(см. п. 2). Потенциал такого водородного электрода постепенно смещается
в отрицательную сторону за счёт увеличения [Н2] и уменьшения[Н+].
В результате этого электродвижущая сила элемента Вольта непрерывно падает. Смещение величины потенциала положительного электрода
в сторону более отрицательных значений называется поляризацией и может быть обусловлено наряду с указанными выше и другими причинами. Например, замедленностью реакции разряда ионов на электроде, которая требует дополнительного напряжения. Цинковый электрод также подвергается поляризации, но в обратном направлении: по мере увеличения концентрации ионов цинка около цинкового электрода его потенциал становится положительнее (6). Процесс устранения поляризации называется деполяризацией. Деполяризация электрода, на котором идёт выделение водорода, может быть вызвана действием специально добавленных в раствор окислителей или кислорода воздуха (по уравнению 4Н2+О2=2Н2О). Процессы поляризации и деполяризации играют большую роль при коррозии металлов и будут рассмотрены особо. Рассмотрим принципы работы гальванического элемента на примере элемента Даниэля — Якоби (рис. 5)
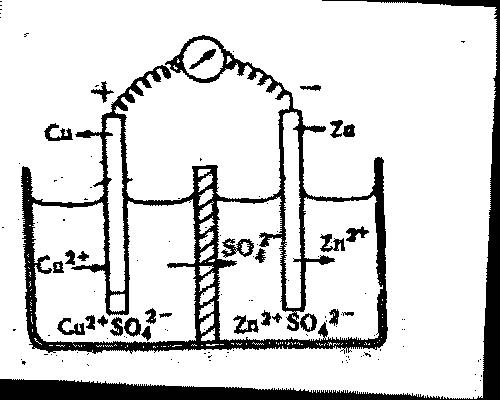
Рис. 5. Гальванический элемент Даниэля - Якоби
 2015-05-20
2015-05-20 704
704








