Cr2S3 + 6Н2О " 2 Cr(OH)3↓+ 3H2S↑
среда близка к нейтральной, рН ≈ 7
Гидролиз некоторых солей, образованных очень слабыми основаниями и кислотами, является практически необратимым процессом, например гидролиз сульфидов и карбонатов Al3+, Cr3+, Fe3+. Эти соединения нельзя получить в водном растворе. При взаимодействии солей Al 3+, Cr3+ и Fe3+ в растворе с сульфидами и карбонатами в осадок выпадают не ожидаемые сульфиды и карбонаты этих катионов, а их гидроксиды:
2AlCl3 + 3Na2S + 6H2O " 2Al(OH)3 ↓ + 3H2S ↑+ 6NaCl
2CrCl3 + 3Na2CO3 + 6H2O " 2Cr(OH)3↓+ 3CO2↓ + 6NaCl
В рассмотренных примерах происходит взаимное усиление гидролиза двух солей (AlCl3 и Na2S или CrCl3 и Na2CO3) и реакции протекают практически до конца.
Cr2S3 + 6Н2О "2 Cr(OH)3 ↓+ 3H2S ↑
среда близка к нейтральной рН ≈ 7
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются. В этом случае равновесие диссоциации воды в присутствии ионов соли почти не нарушается. Поэтому растворы таких солей практически нейтральную реакцию среды.
NaCl– гидролиз не протекает, так как соль образована сильным основанием и сильной кислотой. Среда нейтральная, рН = 7.
Если соль содержит однозарядный катион (анион) и многозарядный анион (катион), то возможен ступенчатый гидролиз. Образующиеся в результате гидролиза по аниону по первой ступени кислые соли могут подвергаться дальнейшему взаимодействию с водой. Однако, вторая и последующая ступени гидролиза выражены менее сильно. Это обусловлено изменением величин констант диссоциации соответствующих электролитов. Например, поскольку ион HCO3- диссоциирует слабее, чем Н2СО3, то он образуется в первую очередь при гидролизе карбоната натрия:
I ступень: Na2CO3 + Н2О D NaНСО3 + NaOH
II ступень: NaНСО3+ Н2О D NaOH + H2CO3
Гидролиз солей слабых многоосновных кислот по второй и третьей ступеням протекает незначительно, и содержание в растворе продуктов гидролиза по этим ступеням ничтожно мало.
Al2(SO4)3 –эта соль подвергается гидролизу, так как образована слабым основанием и сильной кислотой. Среда - кислая. Гидролиз протекает незначительно и, преимущественно, по первой ступени.
Молекулярное уравнение гидролиза:
Al2(SO4)3 + 2Н2О D 2AlOHSO4 + H2SO4
Полное ионно- молекулярное уравнение гидролиза:
2Al 3+ + 3SO4 2- + 2HOH D 2AlOH 2+ + 2H + + 3SO4 2-
среда кислая рН < 7
Краткое ионно- молекулярное уравнение гидролиза:
2Al 3+ + 2HOH D 2AlOH 2+ + 2H +
Al 3+ + HOH D AlOH 2+ + H +
Гидролиз солей, в ряде случаев, может протекать очень сложно. Продукты гидролиза некоторых солей можно установить точно лишь на основании аналитического исследования.
Поскольку при обратимом гидролизе устанавливается динамическое равновесие, то в соответствии с законом действующих масс, можно сместить равновесие в ту или иную сторону введением в раствор кислоты или основания. Этим часто пользуются для усиления или подавления процесса гидролиза.
Константа диссоциации воды увеличивается при повышении температуры в большей степени, чем константы диссоциации продуктов гидролиза – слабых кислот и оснований, поэтому при нагревании степень гидролиза возрастает.
Так как реакция нейтрализации является реакцией экзотермической, то гидролиз, будучи противоположным ей процессом, является процессом эндотермическим. Поэтому, в соответствии с принципом Ле - Шателье, повышение температуры вызывает усиление гидролиза.
В соответствии с тем же принципом процесс гидролиза проходит полнее при разбавлении раствора, так как увеличивается концентрация воды.
Одной из количественных характеристик процесса гидролиза является степень гидролиза (h)
Степень гидролиза – это отношение числа молекул, подвергшихся гидролизу (N) к общему числу молекул в растворе (N0). 
h 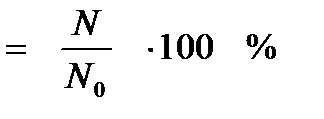
 Степень гидролиза изменяется в пределах от 0 до 100%.
Степень гидролиза изменяется в пределах от 0 до 100%.
Другой количественной характеристикой процесса гидролиза является константа гидролиза .
 2015-05-10
2015-05-10 1821
1821
