В металлургической практике часто используются понятия вытеснение одних оксидов из шлаков другими. Например:
PbO · SiO2 + 2FeO = 2FeO · SiO2 + PbO
2FeO · SiO2 + 2CaO = 2CaO · SiO2 + 2FeO
3CaO · P2O5 + 3SiO2 = 3(CaO · SiO2) + P2O5
На основании этого развито представление о сильных и слабых кислотах и основаниях.
Сильные оксиды вытесняют из химических соединений более слабые. Очевидно, что сила кислотного или основного оксида в расплаве может быть измерена максимальной работой образования соединений из оксидов, приближенно её можно вычислить по уравнению Нернста:
A = W0 – βT2
W0 – тепловой эффект реакции образования соединений из оксидов
β – коэффициент
Чем больше величина максимальной работы - А, тем более «сильно» основание и тем более прочно его соединение с кислотным оксидом.
Например:
Me´O + SiO2 = Me´O · SiO2 + A´
Me´´O + SiO2 = Me´´O · SiO2 + A´´
Для реакции взаимодействия с химическими соединениями получили:
Ме´О · SiO2 + Me´´O ↔ Me´´O · SiO2 + A´´
Величина максимальной работы равна разности максимальных работ образования Ме´´О · SiO2 и Me´O · SiO2 т.е.
А = А´´- А´
Если величина А положительна, то равновесие вышеописанной реакции будет сдвинуто в сторону образования свободного Ме´О, т.е. вправо. Константа равновесия:
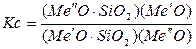
будет большой величиной.
Т.о., если к расплаву силиката Me´O · SiO2 добавить Me´´O, то последний вытеснит Me´O из его соединения, правда, не полностью, а до поступления равновесия. Это мы разобрали с вами вытеснение одних оксидов другими с молекулярной точки зрения.
С точки зрения ионного строения шлаковых расплавов дело выглядит следующим образом. Главное значение имеет проявление растворимостей химических соединений:
Me´O + SiO2 = Me´O · SiO2
Me´O ↔ Me´+2 + O-2
Me´SiO3 ↔ Me´+2 + SiO3-2
LpMe´SiO3 = CMe´+2 ·CSiO3-2
При введении другого оксида в расплаве появляются новые катионы:
Me´´О ↔ Me´´2+ + O2-
При получении в растворе анионов SiO32- будет происходить взаимодействие:
Me´´2+ + SiO32- ↔ Me´´SiO3
Если LpMe´´SiO3 меньше чем LpMe´SiO3, то будет происходить образование нового химического соединения Me´´SiO3. Это вызовет понижение в расплаве концентрации анионов SiO3-2, т.к. константа равновесия, равная
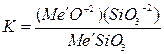
является постоянной при данной температуре. Понижение концентрации в растворе анионов SiO3-2, вызванное связыванием в новое химическое соединение, компенсируется за счет диссоциации новых позиций Me´SiO3. Процесс будет идти до тех пор, пока не установится равновесие. В состоянии равновесия сосуществуют следующие 2 обратимые реакции:
Me´SiO3 ↔ Me´2+ + SiO32-
Me´´SiO3 ↔ Me´´2+ + SiO32-
LpMe´SiO3 = (Me´2+) · (SiO32-)
LpMe´´SiO3 = (Me´´2+) · (SiO32-)
В состоянии равновесия отношение активных по концентрации металлов  Me´2+ и Me´´2- будет равно:
Me´2+ и Me´´2- будет равно:

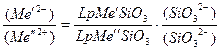
а т.к. концентрация аниона SiO3-2 для обеих реакций будет одно и то же, т.к. мы имеем дело с одним расплавом, то отношение активных концентраций выразится как отношение произведений растворимости химических соединений.
 2015-05-12
2015-05-12 1661
1661
