| Тема: | Кинетика ферментативных реакций Регуляция активности ферментов |
| Цель работы: | - Овладение методами кинетики ферментативных реакций: расчет значений констант Михаэлиса и максимальных скоростей реакций методом двойных обратных величин - Изучение характера ингибирующего действия ацетилхолина на реакцию гидролиза ацетилтиохолина под действием ацетилхолинэстеразы |
Оборудование и материалы:
· Спектрофотометр SOLAR
· Кюветы стеклянные
· Термостат
· Пробирки
· Штативы для пробирок
· Колбы на 100-250мл
· Стакан на 300 мл
· Автоматические микропипетки
· палочки стеклянные
· Бумага миллиметровая
Реактивы:
· Амилаза бактериальная
· Крахмал, 0.25% раствор
· Раствор Люголя (йод, 1% раствор в KJ, 2,5%)
· Сульфат меди (CuSO4), 2% раствор
· Хлорид натрия (NaCl), 1% раствор
· Натрий-фосфатный буфер, 0,1 М рН 7,40
· Мембраны эритроцитов
· Ацетилтиохолин, 1мМ раствор в натрий-фосфатном буфере
· Ацетилхолин, 5мМ раствор в натрий-фосфатном буфере
· Реактив Эллмана
· Вода дистиллированная
Теоретическая часть
Влияние концентрации субстрата на активность фермента
Начальная скорость ферментативной реакции, обозначаемая символом Vо (скорость, измеряемая за период, когда израсходована небольшая доля субстрата) увеличивается по мере роста концентрации субстрата [S] в реакционной смеси. При неизменности остальных условий реакции (концентрации фермента [Е], концентрации кофакторов, температуры) скорость превращения субстрата в продукт увеличивается до определенного значения, называемого максимальной скоростью реакции, V max, которая далее остается постоянной.
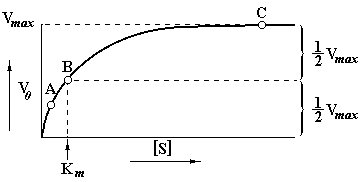 |
Рис. 6.1 Зависимость скорости ферментативной реакции от концентрации субстрата.
Начальная скорость ферментативной реакции, Vо, увеличивается с ростом концентрации субстрата до тех пор, пока не наступит состояние насыщения фермента субстратом. Начальная скорость, измеренная в условиях насыщения, уже не зависит от дальнейшего повышения концентрации субстрата. В ферментативной кинетике обычно используют значительный молярный избыток субстрата по сравнению с концентрацией фермента. Например, если фермент с молекулярной массой 100.000 взаимодействует с субстратом с молекулярной массой 100 и оба компонента присутствуют в реакционной смеси в концентрации 1 мг/мл, каждый, то на один моль фермента будет приходиться 1000 молей субстрата. В клетке наиболее реальными являются следующие численные значения концентраций фермента и субстрата: [E] = 0,1 мкг/мл = 10 – 9 М, [S] = 0,1 мг/мл = 10 – 3 М, т.е. молярный избыток субстрата по отношению к ферменту составляет 106. Даже при уменьшении [S] в 100 раз, его концентрация все еще будет 10.000-кратно превышать концентрацию фермента.
Точкам А, В и С на графике, изображенном на рис. 6.1, соответствуют ситуации А, В и С, приведенные на рис. 6.2.
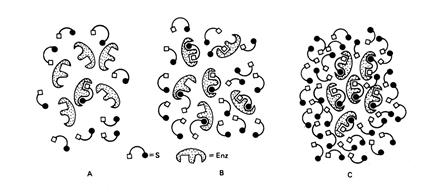
Рис. 6.2 Схема, поясняющая взаимодействие субстрата с ферментом при низкой (А) и высокой (С) концентрации субстрата, а также при концентрации субстрата, равной величине Km (В). Состояния А, В и С соответствуют точкам А, В и С, указанным на кривой рис. 6.1.
Несмотря на то, что молекул субстрата в реакционной смеси намного больше, чем молекул фермента, в точках А и В (рис. 6.1) в связывании субстрата принимает участие небольшая часть молекул фермента. Это происходит по той причине, что константа равновесия реакции взаимодействия субстрата с ферментом E + S «ES (т.е. образование фермент-субстратного комплекса ES) хотя и велика, но конечна. Таким образом, в точках А и В повышение или понижение [S] будет приводить к увеличению или уменьшению доли молекул E, связанных с S (т. е. доли комплексов ES), и Vо будет зависеть от [S]. В точке С на графике (рис. 6.1) практически все молекулы фермента связаны с субстратом. Поэтому, несмотря на повышение частоты столкновений молекул E и S, дальнейшее увеличение [S] не приведет к росту скорости реакции – в реакционной смеси будут отсутствовать молекулы фермента, которые были бы свободны для связывания субстратом.
Случай В представляет особый теоретический интерес. Поскольку при этом ровно половина молекул фермента насыщена субстратом (рис. 6.2) - начальная скорость реакции будет составлять величину, равную половине максимальной скорости (1/2V max), которая может быть достигнута при данной концентрации фермента.
 2015-05-12
2015-05-12 1124
1124
