Исследование кинетики действия ферментов является основой для установления характера действия многих ингибиторов. Ингибиторы можно разделить на две группы –обратимые и необратимые. При действии обратимого ингибитора после его удаления (с помощью диализа) активность фермента восстанавливается (при действии необратимого ингибитора- не восстанавливается). Необратимое ингибирование является прогрессирующим и становится полным в том случае, если весь фермент оказывается связанным с ингибитором, в то время как обратимое ингибирование достигает состояния равновесия, определяемое ингибиторной константой, то есть константой диссоциации комплекса фермент- ингибитор.
Различают три типа обратимого ингибирования, а именно: конкурентное, неконкурентное и бесконкурентное. При конкурентном и неконкурентном ингибировании наблюдается изменение кажущихся величин 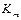
 и
и 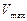 соответственно.
соответственно.
Конкурентный ингибитор - это соединение, которое благодаря большому структурному сходству с истинным субстратом, способно взаимодействовать с активным центром и, следовательно, конкурировать с субстратом за фермент; он увеличивает 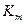 . Скорость реакции снижается, поскольку комплекс фермент- ингибитор является неактивным, то есть не распадается с образованием продуктов. Степень ингибирования зависит от относительных концентраций субстрата и ингибитора, и при достаточно большой концентрации субстрата ингибирование может быть полностью подавлено.
. Скорость реакции снижается, поскольку комплекс фермент- ингибитор является неактивным, то есть не распадается с образованием продуктов. Степень ингибирования зависит от относительных концентраций субстрата и ингибитора, и при достаточно большой концентрации субстрата ингибирование может быть полностью подавлено.
При неконкурентном ингибировании степень обратимого ингибирования зависит только от концентрации ингибитора и не изменяется при варьировании концентрации субстрата. Это свидетельствует о том, что взаимодействие ингибитора с ферментом происходит на участке, важном для активности, но не в самом активном центре, где связывается субстрат, то есть сродство фермента к своему субстрату не изменяется; ингибитор влияет на 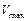 .
.
Бесконкурентное ингибирование наблюдается в том случае, когда ингибитор не взаимодействует со свободным ферментом, а способен связываться только с комплексом фермент- субстрат или другими формами фермента, которые не присоединяют субстрат. Поэтому представляется вероятным, что в том случае, когда образование комплекса с субстратом не изменяет конформацию фермента, взаимодействие комплекса с ингибитором должно осуществляться, по крайней мере частично, при участии связанного субстрата. Бесконкурентное ингибирование влияет как на связывание субстрата так и на максимальную скорость, и, как будет показано ниже, характерной чертой для бесконкурентного ингибирования является уменьшение 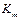 и
и 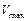 в одно и то же число раз.
в одно и то же число раз.
Следует подчеркнуть, что тип ингибирования, наблюдаемый при действии данного соединения, зависит от природы фермента. Например, соединение может действовать как конкурентный ингибитор по отношению к одному ферменту и как неконкурентный– по отношению к другому.
Установление типа ингибирования (конкурентного, неконкурентного и бесконкурентного) может быть осуществлено экспериментально; при этом используют кинетические уравнения ингибирования.
 2015-05-13
2015-05-13 706
706








