Классическим примером является ингибирование сукцинат-дегидрогеназы малоновой кислотой.
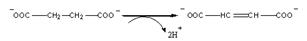
(Реакция катализируется суцинатдегидрогеназой).
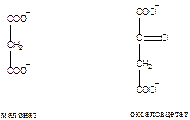
Индол, фенол, бензол, связываясь в гидрофобном кармане химотрипсина, ингибируют гидролиз производных триптофана, фенилаланина, тирозина.
В этих случаях химические структуры ингибитора и субстрата аналогичны, поэтому вполне разумным кажется объяснение, что ингибитор связывается с той же группой (группами) на поверхности белка, что и субстрат. Поскольку из-за сходства химической структуры аналог занимает на поверхности фермента участок связывания субстрата, последний не может связаться с белком, и поэтому активность фермента уменьшается.
В случае конкурентного ингибирования аналог субстрата не влияет на скорость разложения уже образовавшегося комплекса фермент-субстрат, а влияет на величину Ks и Km (при использовании “бесконечно-большого” избытка субстрата получается одна и та же максимальная скорость, как в присутствии, так и в отсутствии ингибитора).
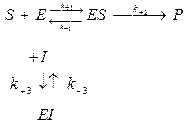
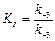
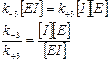
KI – константа ингибирования или константа диссоциации комплекса фермент–ингибитор.
Математической моделью является система дифференциальных уравнений:
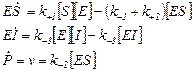
Получим кинетическое уравнение для процесса бесконкурентного ингибирования:
1. Записываем принцип узкого места:
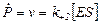 (1)
(1)
2. Используя принцип стационарности, запишем кинетические уравнения для веществ, концентрации которых становятся постоянными со временем:

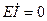
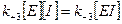 (2)
(2)
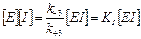
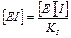 (3)
(3)
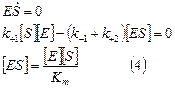
3. Записываем материальный баланс по ферменту и концентрацию комплекса [EI] заменяем формулой (3):
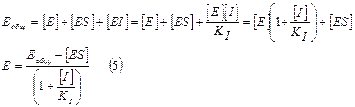
4. Подставим (5) в (4)
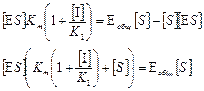
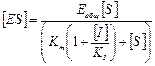 (6)
(6)
5. Подставляем (6) в (1):
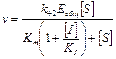 ;
; 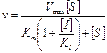 (7)
(7)
(7) – Уравнение для скорости ферментативного процесса, ингибируемого конкурентным ингибитором.
 2015-05-13
2015-05-13 376
376








