В процессе растворения труднорастворимого электролита в момент насыщения раствора устанавливается равновесие в гетерогенной системе осадок – раствор электролита. При этом скорость растворения будет равна скорости осаждения, а DGр-ния=0. Так как растворимость электролита мала, можно считать, что в растворе происходит полная диссоциация и равновесие устанавливается между осадком и его ионами в растворе. Для труднорастворимого электролита АmBn:
АmBn(т) = mAn+ (р-р) + nBm-(р-р)
Согласно закону действия масс для данной гетерогенной системы константа равновесия имеет вид:
ПР = [An+]mž[Bm-]n
Для насыщенного раствора труднорастворимого электролита произведение равновесных молярных концентраций его ионов в степенях их стехиометрических коэффициенто при данной температуре есть величина постоянная и называется произведением растворимости (ПР).
Например:
BaSO4(т) = Ba2+(р-р) + SO42-(р-р)
ПР = [Ba2+][ SO42-]
Ca3(PO4)2(т) = 3Сa2+ + 2PO43-
ПР = [Сa2+]3[PO43-]2
Значение ПР позволяет рассчитать растворимость электролита и концентрацию его ионов в насыщенном растворе.
Если растворимость электролита АmBn равна x моль/л, то в его насыщенном растворе
[An+] = mx [Bm-] = nx
Тогда
ПР = [An+]mž[Bm-]n = (mx)mž(nx)n = mmžnnžxm+n
x = 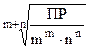 -
-
Пример: Образование костной ткани происходит в результате осаждения труднорастворимого гидроксилапатита Ca5(PO4)3OH. Рассчитайте растворимость гидроксилапатита в воде (ПР = 1,6ž10-58).
Ca5(PO4)3OH(т) = 5Ca2+ + 3PO43- + OH-
ПР = [Ca2+]5[PO43-]3[OH-]
ПР = (5x)5ž(3x)3žx = 83375žx9
x = 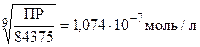
К равновесию в системе осадок – раствор электролита применим принцип Ле Шателье. Введение в раствор ионов, одноименных с ионами осадка смешается равновесие в сторону процесса осаждения и снижает растворимость.
Пример: Рассчитайте растворимость фторида кальция в дистиллированной воде и в жесткой воде с концентрацией ионов Ca2+, равной 0,03 моль/л. Достигается ли в жесткой воде нормальная концентрация ионов F-, равная 1 мг/л (5,3ž10-5моль/л), необходимая для формирования основного вещества зубной эмали фторапатита Ca5(PO4)3F? 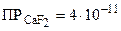
CaF2(т) = Ca2+(р-р) + 2F-(р-р)
ПР = [Ca2+][F-]2 = xž(2x)2 = 4x3
x = 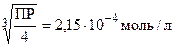 - растворимость фторида кальция в воде.
- растворимость фторида кальция в воде.
В жесткой воде [Ca2+] = y + 0,03» 0,03, т.к. y<<0,03
[F-] = 2y
ПР = 0,03ž4y2 = 0,12 y2
y = 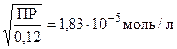 -растворимость CaF2 в жесткой воде.
-растворимость CaF2 в жесткой воде.
[F-] = 2y = 3,65ž10-5 моль/л < 5,3ž10-5моль/л
Таким образом, в жесткой воде невозможно достижение нормальной концентрации фторид-ионов, необходимой для формирования зубной эмали.
Уменьшение концентрации одноименных ионов в растворе над осадком за счет их связывания в слабый электролит или другое труднорастворимое соединение в соответствии с принципом Ле Шателье смешает равновесие в сторону процесса растворения и увеличивает растворимость.
Пример: Токсическое действие ионов стронция обусловлено их способностью замещать ионы кальция в основном веществе костной ткани, что приводит к повышенной ломкости костей (стронциевый рахит). При какой наименьшей концентрации ионов стронция в растворе возможно превращение осадка Ca3(PO4)2 в осадок Sr3(PO4)2? (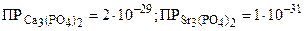 )
)
Рассчитаем концентрацию фосфат-ионов в насыщенном растворе фосфата кальция:
Ca3(PO4)2(т) = 3Сa2+ + 2PO43-
ПР = [Сa2+]3[PO43-]2 = (3x)3ž(2x)2 = 108x5
x = 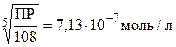
[PO43-] = 2x = 1,43ž10-6 моль/л
Рассчитаем минимальную концентрацию ионов стронция, необходимую для осаждения фосфат-ионов из насыщенного раствора фосфата кальция в виде фосфата стронция:
ПР = [Sr2+]3[PO43-]2
[Sr2+] = 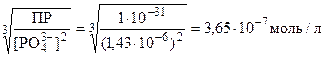
 2015-05-26
2015-05-26 3778
3778
