Периодические изменения свойств химических элементов обусловлены правильным повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра.
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Период - горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов.
Номер периода обозначает число энергетических уровней в атоме элемента.
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов, в зависимости от количества электронов на внешнем энергетическом уровне. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом (ns2 np6).
Металлические свойства рассматриваются, как способность атомов элементов легко отдавать электроны, а неметаллические - присоединять электроны из-за стремления атомов приобрести устойчивую конфигурацию с заполненными подуровнями. Заполнение внешнего s- подуровня указывает на металлические свойства атома, а формирование внешнего p- подуровня - на неметаллические свойства. Увеличение числа электронов на p- подуровне (от 1 до 5) усиливает неметаллические свойства атома. Атомы с полностью сформированной, энергетически устойчивой конфигурацией внешнего электронного слоя (ns2 np6) химически инертны.
В больших периодах переход свойств от активного металла к благородному газу происходит более плавно, чем в малых периодах, т.к. происходит формирование внутреннего (n - 1) d- подуровня при сохранении внешнего ns2 - слоя. Большие периоды состоят из четных и нечетных рядов.
У элементов четных рядов на внешнем слое ns2 - электроны, поэтому преобладают металлические свойства и их ослабление с ростом заряда ядра невелико; в нечетных рядах формируется np- подуровень, что объясняет значительное ослабление металлических свойств.
Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы.
Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и np- подуровнях.
Побочные подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем ns- подуровне и внутреннем (n - 1) d- подуровне (или (n - 2) f- подуровне).
В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными электронами, элементы периодической системы подразделяются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III - VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды).
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы меди и восьмой группы).
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I - III групп (кроме бора) преобладают основные свойства, с IV по VIII - кислотные.
| Группа | I | II | III | IV | V | VI | VII | VIII (кроме инертных газов) |
| Высший оксид | Э2О | ЭО | Э2О3 | ЭО2 | Э2О5 | ЭО3 | Э2О7 | ЭО4 |
| Гидрат высшего оксида | ЭОН | Э(ОН)2 | Э(ОН)3 | Н2ЭО3 | Н2ЭО4 | Н3ЭО4 | НЭО4 | Н4ЭО4 |
Для элементов главных подгрупп общими являются формулы водородных соединений. Элементы главных подгрупп I - III групп образуют твердые вещества - гидриды (водород в степени окисления - 1), а IV - VII групп - газообразные. Водородные соединения элементов главных подгрупп IV группы (ЭН4) - нейтральны, V группы (ЭН3) - основания, VI и VII групп (Н2Э и НЭ) - кислоты.
От положения элементов в периодической системе зависят свойства атома, связанные с его электронной конфигурацией: атомный радиус - по периоду слева направо уменьшается, а в подгруппе сверху вниз возрастает; энергия ионизации - по периоду возрастает, а в подгруппе уменьшается; электроотрицательность - по периоду увеличивается, а в подгруппе уменьшается.
По положению элемента в периодической системе можно прогнозировать его основные свойства как средние всех его соседей:
Состояние электронов в атоме с позиции квантово-механической модели оп-
ределяется плотностью вероятности обнаружения электрона в данной области про-
странства. Граничная поверхность, внутри которой сосредоточена область наи-
большей вероятности обнаружения электрона, называется атомной орбиталью
(АО). Атомная орбиталь характеризуется набором трёх параметров, называемых
квантовыми числами.
Главное квантовое число n в основном опpеделяет энеpгию АО. Его зна-
чение равно номеру энергетического уровня, на котором находится электрон.
Оpбитальное квантовое число в основном опpеделяет фоpму АО и, в
некоторой степени, ее энеpгию. Значение определяет энергетический
подуровень (s-, p-, d- или f-), на котором находится электрон.
Магнитное квантовое число m опpеделяет пpостpанственную оpиентацию
данной АО.
Кpоме этих квантовых чисел, хаpактеpизующих АО, имеется еще одно
квантовое число − s (спиновое), являющееся собственной хаpактеpистикой
электpона.
Электроны в атоме расположены на энергетических уровнях, которые со-
держат различные энергетические подуровни, состоящие, в свою очередь, из
определенного количества атомных орбиталей: s- подуровень состоит из одной,
р- подуровень ─ из трех, d- подуровень ─ из пяти и f- подуровень ─ из семи
орбиталей.
Условная запись, представляющая распределение электронов атома по энерге-
тическим уровням и подуровням (атомным орбиталям), называется электронной
формулой атома. Для составления электронной формулы, в которой представ-
лено состояние каждого электрона (его энергия, форма орбитали, магнитные ха-
рактеристики), необходимо знать:
− последовательность заполнения подуровней электронами (принцип наименьшей
энергии),
− максимальную емкость каждого подуровня.
При распределении электронов по квантовым ячейкам следует руководство-
ваться принципом Паули: в атоме не может быть двух электронов с одинаковым
набором значений всех квантовых чисел, т.е. атомная орбиталь не может содер-
жать более двух электронов, причем их спиновые моменты должны быть проти-
воположными
↑↓
Система обозначений в общем виде выглядит так:
nℓx,
где п − главное, ℓ − орбитальное квантовые числа; х − количество электронов,
находящихся в данном квантовом состоянии. Например, запись 4d3 может быть
истолкована следующим образом: три электрона занимают четвертый энергетиче-
ский уровень, d- подуровень.
Характер застройки энергетических подуровней определяет принадлежность
элемента к тому или иному электронному семейству.
В s-элементах происходит застройка внешнего s-подуровня, например,
11 Na 1s2 2s2 2p6 3s1
В р-элементах происходит застройка внешнего р-подуровня, например,
9 F 1s 2s2 2p5.
К s- и p- семействам относятся элементы главных подгрупп периодической табли-
цы Д. И. Менделеева.
В d-элементах происходит застройка d-подуровня предпоследнего уровня,
например,
2 2 6 2 6 2 2
22Ti 1s 2s 2p 3s 3p 3d 4s.
К d-семейству относятся элементы побочных подгрупп. Валентными у этого се-
мейства являются s-электроны последнего энергетического уровня и d-электроны
предпоследнего уровня.
В f-элементах происходит застройка f-подуровня третьего наружного уровня,
например,
58Се 1s22s22p63s23p63d l04s24p64d l04f l5s25p65d16s2.
Представителями f-электронного семейства являются лантаноиды и актиноиды. Основная статья: Одноэлектронная химическая связь
Простейшая одноэлектронная химическая связь создаётся единственным валентным электроном. Оказывается, что один электрон способен удерживать в едином целом два положительно заряженных иона. В одноэлектронной связи кулоновские силы отталкивания положительно заряженных частиц компенсируются кулоновскими силами притяжения этих частиц к отрицательно заряженному электрону. Валентный электрон становится общим для двух ядер молекулы.
Примерами таких химических соединений являются молекулярные ионы: H2+, Li2+, Na2+, K2+, Rb2+, Cs2+[2]:
| Элемент | H | Li | Na | K | Rb | Cs |
| Электронная конфигурация | 1S1 | [He]2S1 | [Ne]3S1 | [Ar]4S1 | [Kr]5S1 | [Xe]6S1 |
| Межъядерное расстояние в молекулярном ионе xz+, Å | 1,06 | 3,14 | 3,43 | 4,18 | 4,44 | 4,70 |
| Орбитальный радиус атома, Å | 0,53 | 1,57 | 1,715 | 2,09 | 2,22 | 2,35 |
Существование молекулярных ионов водорода и щелочных металлов, в которых химическую связь создаёт единственный валентный электрон, расширяет и дополняет понятие химической связи. В перечисленных ионах ни о каком взаимодействии спинов электронов и перекрывания электронных облаков речи быть не может. Единственный связывающий электрон локализуется в пространстве между ядрами атомов и удерживает их в едином целом, образуя устойчивую химическую систему (рис.1).
Одинарная ковалентная связь [править | править исходный текст]
Основная статья: Электронная теория химической связи
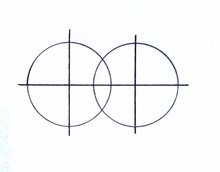

Рис.2.Неполярная ковалентная связь
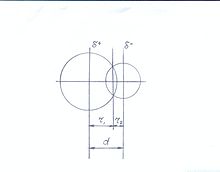

Рис.3.Полярная ковалентная связь
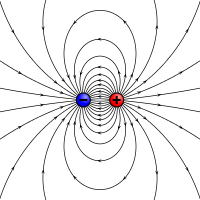

Рис.4.Силовые линии электрического диполя
Одинарная ковалентная химическая связь создаётся связывающей электронной парой. Во всех существующих теориях (теория валентных связей, теория молекулярных орбиталей, теория отталкивания валентных электронных пар,боровская модель химической связи) связывающая электронная пара располагается в пространстве между атомами молекулы. Различают полярную и неполярную ковалентную связи.
Неполярная ковалентная связь имеет место в гомоядерных двухатомных молекулах, в которых связывающая электронная пара равноудалена от обоих ядер молекулярной системы (рис.2). Расстояние d между атомными ядрами можно рассматривать как сумму ковалентных радиусов соответствующих атомов.
Расстояние между атомными ядрами в одинарной двухэлектронной ковалентной связи короче аналогичного расстояния в простейшей одноэлектронной химической связи.
| Молекула | H2 | Li2 | Na2 | K2 | Rb2 | Cs2 |
| Межъядерное расстояние, Å [3] | 0,74 | 2,67 | 3,08 | 3,92 | 4,10 | 4,30 |
| Ковалентный радиус, Å | 0,37 | 1,335 | 1,54 | 1,96 | 2,05 | 2,15 |
| Орбитальный радиус, Å | 0,53 | 1,57 | 1,715 | 2,09 | 2,22 | 2,35 |
| Радиус связывающей электронной пары, Å | 0,379 | 0,826 | 0,755 | 0,726 | 0,852 | 0,949 |
| Энергия разрыва связи, кДж/моль [3] |
Разность между орбитальными и ковалентными радиусами характеризует степень перекрытия атомных орбиталей атомов, образующих химическую связь, и отражает деформацию электронной оболочки атомов.
Полярная ковалентная связь возникает в гетероядерных двухатомных молекулах (рис.3). Связывающая электронная пара в полярной химической связи приближена к атому с более высоким первым потенциалом ионизации.[4]
Характеризующее пространственную структуру полярных молекул расстояние d между атомными ядрами можно приближённо рассматривать как сумму ковалентных радиусов соответствующих атомов.[5]
Характеристика некоторых полярных веществ[3]
| Молекула | LiH | NaH | KH | RbH | CsH |
| Межъядерное расстояние, Å | 1,60 | 1,89 | 2,24 | 2,37 | 2,49 |
| Энергия разрыва связи, кДж/моль |
Сдвиг связывающей электронной пары к одному из ядер полярной молекулы приводит к появлению электрического диполя (электродинамика) (рис.4).
Расстояние между центрами тяжести положительного и отрицательного зарядов называют длиной диполя. Полярность молекулы, как и полярность связи, оценивают величиной дипольного момента μ, представляющего собой произведение длины диполя l на величину электронного заряда:
μ = lq
Кратные ковалентные связи [править | править исходный текст]
Основная статья: Теория изогнутой химической связи
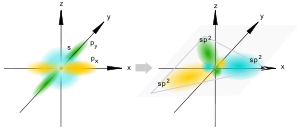

Рис.5.sp2-гибридизация
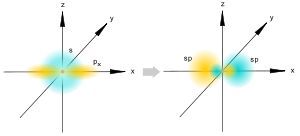

Рис.6.sp-гибридизация
Кратные ковалентные связи представлены непредельными органическими соединениями, содержащими двойную и тройную химические связи. Для описания природы непредельных соединений Л.Полинг вводит понятия сигма- и π-связей, гибридизации атомных орбиталей.
Гибридизация Полинга для двух S- и двух p- электронов позволила объяснить направленность химических связей, в частности тетраэдрическую конфигурацию метана. Для объяснения структуры этилена из четырёх равноценных Sp3- электронов атома углерода приходится вычленять один p-электрон для образования дополнительной связи, получившей название π-связи. При этом три оставшиеся Sp2-гибридные орбитали располагаются в плоскости под углом 120° и образуют основные связи, например, плоскую молекулу этилена (рис.5).
В случае молекулы ацетилена в гибридизации принимают участие (по Полингу) всего лишь одна S- и одна p-орбитали, при этом образуются две Sp-орбитали, расположенные под углом в 180° и направленные в противоположные сороны. Две «чистые» p-орбитали атомов углерода попарно перекрываются во взаимоперпендикулярных плоскостях, образуя две π-связи линейной молекулы ацетилена (рис.6).
Взгляды Л.Полинга нашли отражение в его книге «Природа химической связи»[6], на долгие годы ставшей настольной книгой химика. В 1954 году Л.Полинг удостоен Нобелевской премии по химии с формулировкой «За исследование природы химической связи и его применение для опеделения структуры сложных соединений».
Однако физический смысл избирательной гибридизации атомных орбиталей оставался неясным, гибридизация представляла собой алгебраические преобразования, которым не могла быть приписана физическая реальность.
Лайнус Полинг предпринял попытку улучшения описания химической связи, исключив избирательность гибридизации орбиталей в молекулах непредельных соединений и создав теорию изогнутой химической связи. В своём докладе на симпозиуме по теоретической органической химии, посвящённой памяти Кекуле (Лондон, сентябрь 1958 года), Л.Полинг предложил новый путь описания двойной связи как комбинации двух одинаковых изогнутых химических связей, а тройной связи — трёх изогнутых химических связей[7]. На этом симпозиуме Л.Полинг со всей категоричностью утверждал:
Могут найтись химики, полагающие что чрезвычайно важным новшеством… явилось описание σ,π- описания для двойной или тройной связи и сопряжённых систем вместо описания с помощью изогнутых связей. Я же утверждаю, что σ,π- описание менее удовлетворительно, чем описание с помощью изогнутых связей, что это нововведение является только переходящим и вскоре отомрёт. [7]
В новой теории Полинга все связывающие электроны становились равноценными и равноудалёнными от линии, соединяющей ядра молекулы. Теория изогнутой химической связи Полинга учитывала статистическую интерпретацию волновой функции М.Борна, кулоновскую электронную корреляцию электронов. Появился физический смысл — природа химической связи полностью определяется электрическим взаимодействием ядер и электронов. Чем больше связывающих электронов, тем меньше межъядерное расстояние и прочнее химическая связь между атомами углерода.
| Кратность связи | Структура связи | Межъядерное расстояние, Å | Энергия связи, кДж/моль |
| Одинарная (C-C) | Двухэлектронная двухцентровая | 1,54 | |
| Двойная (C=C) | Четырёхэлектронная двухцентровая | 1,34 | |
| Тройная (C=C) | Шестиэлектронная двухцентровая | 1,20 |
Трёхцентровая химическая связь [править | править исходный текст]
Основная статья: Двухэлектронная трёхцентровая связь
Дальнейшее развитие представлений о химической связи дал американской физикохимик У.Липскомб, разработавший теорию двухэлектронных трёхцентровых связей и топологическую теорию, позволяющую предсказывать строение ещё некоторых гидридов бора (бороводородов).
Электронная пара в трёхцентровой химической связи становится общей для трёх ядер атомов. В простейшем представителе трёхцентровой химической связи — молекулярном ионе водорода H3+ электронная пара удерживает в едином целом три протона.
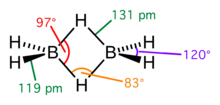

Рис.7.Диборан
В молекуле диборана функционируют четыре одинарные ковалентные связи B-H и две двухэлектронные трёхцентровые связи (рис.7). Межъядерное расстояние в одинарной ковалентной связи B-H составляет 1,19 Å, в то время как аналогичное расстояние в трёхцентровой связи B-H-B составляет 1,31 Å. Угол трёхцентровой связи B-H-B (φ) равен 830. Комбинация двух трёхцентровых связей в молекуле диборана позволяет удерживать ядра атомов бора на расстоянии dB-B = 2 · 1,31 · sin φ/2 = 1,736 Å. Ядра связывающих атомов водорода удалены от плоскости, в которой расположены четыре одинарные ковалентные связи B-H, на расстоянии h = 1,31 · cos φ/2 = 0,981 Å.
Трёхцентровые связи могут реализоваться не только в треугольнике из двух атомов бора и одного атома водорода, но и между тремя атомами бора, например в каркасных бороводородах (пентаборан — B5H9, декаборан — B10H4 и др.). В этих структурах есть обычные (концевые) и входящие в трёхцентровую связь (мостиковые) атома водорода и треугольники из атомов бора.[8]
Существование боранов с их двухэлектронными трёхцентровыми связями с «мостиковыми» атомами водорода нарушало каноническое учение о валентности. Атом водорода, считавшийся ранее стандартным одновалентным элементом, оказался связанным одинаковыми связями с двумя атомами бора и стал формально двухвалентным элементом. Работы У.Липскомба по расшифровке строения боранов расширяли представления о химической связи. Нобелевский комитет удостоил Уильяма Нанна Липскомба премии по химии за 1976 год с формулировкой "За исследования структуры боранов (боргидритов), проясняющие проблемы химических связей).
Многоцентровая химическая связь [править | править исходный текст]
Основная статья: Ферроцен

Рис.8.Молекула ферроцена
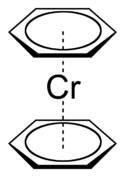

Рис.9.Дибензолхром
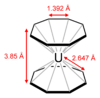

Рис.10.Ураноцен
В 1951 году Т.Кили и П.Посон неожиданно при синтезе дициклопентадиенила получили совершенно новое железоорганическое соединение. Получение неизвестного ранее исключительно устойчивого жёлто-оранжевого кристаллического соединения железа сразу привлекло к себе внимание.
Э.Фишер и Д.Уилкинсон независимо друг от друга установили структуру нового соединения — два кольца циклопентадиенила расположены параллельно, слоями, или в виде «сэндвича» с атомом железа, расположенным между ними по центру (рис.8). Название «ферроцен» было предложено Р.Вудвордом (вернее, сотрудником его группы Д.Уайтингом). В нём отражено наличие в соединении атома железа и десяти углеродных атомов (zehn — десять).[8]
Все десять связей (C-Fe) в молекуле ферроцена равноценны, величина межъядерного расстояния Fe-c — 2,04 Å. Все атомы углерода в молекуле ферроцена структурно и химически эквивалентны, длина каждой связи C-C 1,40 — 1,41 Å (для сравнения, в бензоле длина связи C-C 1,39 Å). Вокруг атома железа возникает 36- электронная оболочка.[8]
В 1973 году Эрнст Отто Фишер и Джефри Уилкинсон были удостоены Нобелевской премии по химии с формулировкой «За новаторскую, проделанную независимо друг от друга работу, в области металлоорганических, так называемых сандвичевых соединений». Индвар Линдквист, член Шведской королевской академии наук, в своей речи при презентации лауреатов, заявил, что «открытие и доказательство новых принципов связей и структур, имеющихся в сандвичевых соединениях, являются значительным достижением, практическую значимость которых в настоящее время ещё невозможно предсказать».
В настоящее время получены дициклопентадиенильные производные многих металлов. Производные переходных металлов имеют ту же структуру и ту же природу связи, что и ферроцен. Лантаноиды образуют не сандвичеву структуру, а конструкцию, напоминающую трёхлучевую звезду[8]. Атомы La, Ce, Pr, Nd создают, следовательно, пятнадцати центровую химическую связь.
Вскоре вслед за ферроценом был получен дибензолхром (рис.9). По той же схеме получены дибензолмолибден и дибензолванадий[8]. Во всех соединениях этого класса атомы металла удерживают в едином целом два шестичленных кольца. Все 12 связей металл-углерод в этих соединениях идентичны.
Синтезирован также ураноцен [бис(циклооктатетраен)уран], в котором атом урана удерживает два восьмичленных кольца (рис.10). Все 16 связей уран-углерод в ураноцене идентичны. Ураноцен получают взаимодействием UCl4 со смесью циклооктатетраена и калия в тетрагидрофуране при минус 300 C.[9]
Динамика химической связи[править | править исходный текст]
Химическая связь достаточно динамична. Так, металлическая связь трансформируется в ковалентную в процессе фазового перехода при испарении металла. Переход металла из твёрдого в парообразное состояние требует затраты больших количеств энергии.[10]
| Металл | Li | Na | K | Rb | Cs |
| Теплота возгонки (ккал/г-атом) |
В парах указанные металлы состоят практически из гомоядерных двухатомных молекул и свободных атомов. При конденсации паров металла ковалентная связь превращается в металлическую.
Испарение солей с типичной ионной связью, например фторидов щелочных металлов, приводит к разрушению ионной связи и образованию гетероядерных двухатомных молекул с полярной ковалентной связью. При этом имеет место образование димерных молекул с мостиковыми связями.
Характеристика химической связи в молекулах фторидов щелочных металлов и их димерах.[3][11]
| ЭF | dЭF, Å | μ, D | Э2F2 | dЭF, Å | <F-Э-F |
| LiF | 1,56 | 6,60 | Li2F2 | 1,75 | 105° |
| NaF | 1,93 | - | Na2F2 | 2,08 | 95° |
| KF | 2,17 | 7,37 | K2F2 | 2,35 | 88° |
| RbF | 2,27 | - | Rb2F2 | 2,45 | 84° |
| CsF | 2,35 | 7,88 | Cs2F2 | 2,56 | 79° |
При конденсации паров фторидов щелочных металлов полярная ковалентная связь трансформируется в ионную с образованием соответствующей кристаллической решётки соли.
Механизм перехода ковалентной в металлическую связь [править | править исходный текст]
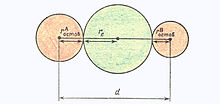

Рис.11. Соотношение между радиусом орбитали электронной пары re и длиной ковалентной химической связи d
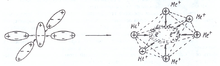

Рис.12.Ориентация диполей двухатомных молекул и образование искажённого октаэдрического фрагмента кластера при конденсации паров щелочных металлов
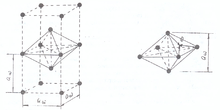

Рис.13.Объёмноцентрированное кубическое расположение ядер в кристаллах щелочных металлов и связывающего звена
Дисперсное притяжение (силы Лондона) обуславливает межатомное взаимодействие и образование гомоядерных двухатомных молекул из атомов щелочных металлов.
Образование ковалентной связи металл-металл сопряжено с деформацией электронных оболочек взаимодействующих атомов — валентные электроны создают связывающую электронную пару, электронная плотность которой концентрируется в пространстве между атомными ядрами возникшей молекулы. Характерной особенностью гомоядерных двухатомных молекул щелочных металлов является большая длина ковалентной связи (в 3,6-5,8 раза больше длины связи в молекуле водорода) и низкая энергия её разрыва.
В теории отталкивания электронных пар считается важным соотношение между радиусом орбитали электронной пары re и длиной ковалентной химической связи d (рис.11). Для элементов каждого периода таблицы Д. И. Менделеева существует некоторый радиус электронной пары (Å):
— 0,6 для элементов вплоть до неона;
— 0,75 для элементов вплоть до аргона;
— 0,75 для элементов вплоть до криптона;
— 0,8 для элементов вплоть до ксенона[12]
Указанное соотношение между re и d определяет неравномерность распределения электрических зарядов в молекуле — в средней части молекулы сосредоточен отрицательный электрический заряд связывающей электронной пары, а на концах молекулы — положительные электрические заряды двух атомных остовов.
Неравномерность распределения электрических зарядов создаёт условия взаимодействия молекул за счёт ориентационных сил (силы Ван-дер-Ваальса). Молекулы щелочных металлов стремятся ориентироваться таким образом, чтобы по сосоедству оказывались разноимённые электрические заряды. В результате между молекулами действуют силы притяжения. Благодаря наличию последних, молекулы щелочных металлов сближаются и более менее прочно стягиваются между собой. Одновременно происходит некоторая деформация каждой из них под действием ближе расположенных полюсов соседних молекул (рис.12).
Фактически, связывающие электроны исходной двухатомной молекулы, попадая в электрическое поле четырёх положительно заряженных атомных остовов молекул щелочных металлов отрываются с орбитального радиуса атома и становятся свободными.
При этом связывающая электронная пара становится общей уже для системы с шестью катионами. Начинается построение кристаллической решётки металла на этапе кластера. В кристаллической решётке щелочных металлов чётко выражена структура связывающего звена, имеющего форму искажённого сплющенного октаэдра — квадратной бипирамиды, высота которой и рёбра базиса равны величина постоянной трансляционной решётки aw (рис.13).
Величина постоянной трансляционной решётки aw кристалла щелочного металла значительно превышает длину ковалентной связи молекулы щелочного металла, поэтому принято считать, что электроны в металле находятся в свободном состоянии:
| Щёлочный металл | Li | Na | K | Rb | Cs |
| Постоянная решётка aw,Å [13] | 3,5021 | 4,2820 | 5,247 | 5,69 | 6,084 |
| Длина ковалентной связи, Me2, Å [14] | 2,67 | 3,08 | 3,92 | 4,10 | 4,30 |
Математическое построение, связанное со свойствами свободных электронов в металле, обычно отождествляют с «поверхностью Ферми», которую следует рассматривать как геометрическое место, где пребывают электроны, обеспечивая основное свойство металла — проводить электрический ток.[15]
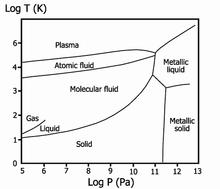

Рис.14.Фазовая диаграмма водорода
При сопоставлении процесса конденсации паров щелочных металлов с процессом конденсации газов, например, водорода, проявляется характерная особенность в свойствах металла. Так, если при конденсации водорода проявляются слабые межмолекулярные взаимодействия, то при конденсации паров металла протекают процессы, характерные для химических реакций. Сама конденсация паров металла идёт в несколько стадий и может быть описана следующей процессией: свободный атом → двухатомная молекула с ковалентной связью → металлический кластер → компактный металл с металлической связью.
В 1935 году Юджин Вигнер и Хиллард Хантингтон предсказали возможность существования и металлического водорода. Действительно, ковалентная связь, свойственная молекулярному водороду, переходит в металлическую связь. Этот переход наблюдается для твёрдого водорода при высоком давлении (рис.14).
Механизм перехода ковалентной в ионную связь [править | править исходный текст]

Рис.15.Димеризация полярных молекул
Переход ковалентной в ионную связь наблюдается для гетероядерных двухатомных молекул с полярной ковалентной связью, например, галогенидов щелочных металлов при переходе из газообразного в твёрдое состояние.
Атомы щелочных металлов при образовании соответствующего галогенида расходуют свой единственный внешний электрон и приобретают чётко выраженный положительный электрический заряд. Отрицательный электрический заряд фиксируется на атоме галогена. Молекулы галогенидов щелочных металлов фактически являются электрическими диполями.
Длина химической связи в молекулах галогенидов щелочных металлов (газовая фаза).[3]
| ЭX | Длина химической связи, Å | |||
| ЭF | ЭCl | ЭBr | ЭI | |
| LiX | 1,56 | 2,02 | 2,17 | 2,39 |
| NaX | 1,93 | 2,36 | 2,50 | 2,71 |
| KX | 2,17 | 2,67 | 2,82 | 3,05 |
| Rbx | 2,27 | 2,79 | 2,95 | 3,18 |
| CsX | 2,35 | 2,91 | 3,07 | 3,32 |
Распределение силовых линий электрического диполя полярной ковалентной связи представлено на рис.4. При достаточно близких расстояниях силовые линии взаимно ориентируют полярные молекулы — одноимённо заряженные концы (полюса) их диполей взаимно отталкиваются, а разноимённо заряженные притягиваются. В результате между молекулами действуют силы притяжения, обусловленные взаимодействием их постоянных диполей и носящие название ориентационных сил.
Взаимодействие молекул галогенидов щелочных металлов сопровождается их димеризацией. Димерную молекулу можно рассматривать как электрический квадруполь (рис.15). В настоящее время известны основные характеристики димеров галогенидов щелочных металлов (длины химической связи и валентные углы между связями).[11]
Длина химической связи и валентные углы в димерах галогенидов щелочных металлов (Э2X2)(газовая фаза).[11]
| Э2X2 | X=F | X=Cl | X=Br | X=I | ||||
| dЭF, Å | <F-Э-F,° | dЭCl, Å | <Cl-Э-Cl,° | dЭBr, Å | <Br-Э-Br, ° | dЭI, Å | <I-Э-I, ° | |
| Li2X2 | 1,75 | 2,23 | 2,35 | 2,54 | ||||
| Na2X2 | 2,08 | 2,54 | 2,69 | 2,91 | ||||
| K2X2 | 2,35 | 2,86 | 3,02 | 3,26 | ||||
| Cs2X2 | 2,56 | 3,11 | 3,29 | 3,54 |
В процессе конденсации действие ориентационных сил усиливается, межмолекулярное взаимодействие сопровождается образованием кластеров, а затем и твёрдого вещества. Галогениды щелочных металлов образуют кристаллы с простой кубической и объёмно-центрированной кубической решёткой.
Тип кристаллической решётки и постоянная трансляционной решётки для галогенидов щелочных металлов.[13]
| Соединения и тип кристаллической решётки | Постоянная решётки, Å | ||||
| Li | Na | K | Rb | Cs | |
| фториды (куб) | 4,0279 | 4,628 | 5,344 | 5,64 | 6,020 |
| хлориды (куб) | 5,1399 | 5,639 | 6,21 | - | - |
| хлориды (ОЦК) | - | - | - | 3,749 | 4,10 |
| бромиды (куб) | 5,501 | 5,973 | 6,599 | 6,868 | 7,23 |
| бромиды (ОЦК) | - | - | - | - | 4,296 |
| иодиды (куб) | 6,012 | 6,475 | 7,066 | 7,340 | 7,66 |
| иодиды (ОЦК) | - | - | - | - | 4,567 |
В процессе кристаллизации происходит дальнейшее увеличение межатомного расстояния, приводящее к срыву электрона с орбитального радиуса атома щелочного металла и передаче электрона атому галогена с образованием соответствующих ионов. Силовые поля ионов равномерно распределяются во всех направлениях в пространстве. В связи с этим в кристаллах щелочных металлов силовое поле каждого иона координирует отнюдь не один ион с противоположным знаком, как принято качественно представлять ионную связь (Na+Cl-).
В кристаллах ионных соединений понятие простых двухионных молекул типа Na+Cl- и Cs+Cl- теряет смысл, поскольку ион щелочного металла связан с шестью ионами хлора (в кристалле хлористого натрия) и с восемью ионами хлора (в кристалле хлористого цезия. При этом все межионные расстояния в кристаллах равноудалены.
 2015-05-23
2015-05-23 2468
2468