Понижение давления насыщенного пара раствора влияет на температуры кристаллизации и кипения. На рисунке представлены температурные зависимости давления насыщенного пара над чистым растворителем (кривая АОВ) и растворителя над раствором (кривая АО/В/). Растворенное вещество нелетучее и не образует твердых растворов с растворителем, т.е. в газовую и твердую фазы переходит только чистый растворитель.
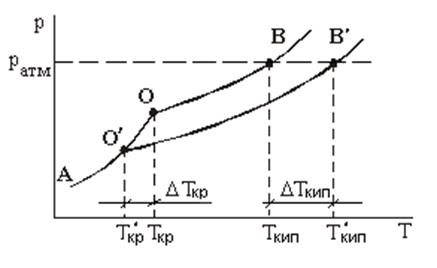
Участок АО кривой АОB отражает температурную зависимость давления насыщенного пара над твердым растворителем, участок OB ‑ температурную зависимость давления насыщенного пара над жидким растворителем. Участок О/B/ характеризует температурную зависимость давления насыщенного пара над раствором.
Жидкость кристаллизуется при температуре, которой соответствует одинаковое давление насыщенного пара над твердой и жидкой фазами. Для чистого растворителя это происходит при температуре, соответствующей точке О, т.е. Ткр ‑ температура кристаллизации чистого растворителя.
Для раствора давление насыщенного пара над твердой и жидкой фазами становится равным в точке О/, т.е. Ткр/ ‑ температура кристаллизации раствора.
Температура кристаллизации раствора ниже температуры кристаллизации чистого растворителя.
Жидкость кипит при той температуре, при которой давление насыщенного пара становится равным атмосферному давлению. При давлении pатм температура кипения чистого растворителя Ткип, температура кипения раствора Ткип/.
При постоянном атмосферном давлении температура кипения раствора выше температуры кипения чистого растворителя.
Количественные зависимости для растворов неэлектролитов имеют вид:
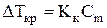 , (1)
, (1)
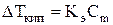 , (2)
, (2)
для растворов электролитов
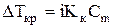 ; (3)
; (3)
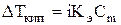 . (4)
. (4)
где 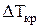 ‑ понижение температуры замерзания раствора по сравнению
‑ понижение температуры замерзания раствора по сравнению
с температурой замерзания чистого растворителя;
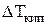 ‑ повышение температуры кипения раствора по сравнению
‑ повышение температуры кипения раствора по сравнению
с температурой кипения чистого растворителя;
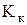 ‑ криоскопическая постоянная;
‑ криоскопическая постоянная;
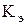 ‑ эбулиоскопическая постоянная;
‑ эбулиоскопическая постоянная;
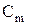 ‑ моляльная концентрация (моляльность) раствора.
‑ моляльная концентрация (моляльность) раствора.
· Моляльная концентрация раствора 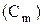 – отношение количества растворенного вещества к массе растворителя (размерность – моль/кг).
– отношение количества растворенного вещества к массе растворителя (размерность – моль/кг).
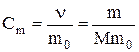 ,
,
где 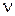 ‑ количество растворенного вещества, моль;
‑ количество растворенного вещества, моль;
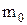 ‑ масса растворителя, кг;
‑ масса растворителя, кг;
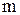 ‑ масса растворенного вещества, г;
‑ масса растворенного вещества, г;
M – молярная масса растворенного вещества, г/моль.
Криоскопическая и эбулиоскопическая постоянные показывают, соответственно, на сколько градусов понижается температура кристаллизации и повышается температура кипения одномоляльного раствора (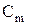 =1 моль/кг).
=1 моль/кг).
| Постоянные растворителей | Значения Кк и Кэ растворителей, К.моль-1.кг | ||
| вода | бензол | тетрахлорид углерода | |
| Kк Кэ | 1,86 0,52 | 5,12 2,53 | 29,8 5,02 |
Значения 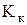 и
и 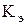 определяются природой растворителя:
определяются природой растворителя:
Эффект понижения температуры кристаллизации при образовании растворов широко используют в технике для приготовления антифризов – жидкостей с пониженной температурой замерзания, применяющихся в системах охлаждения двигателей.
Пример 1. Определите температуру замерзания антифриза, приготовленного из 20 л воды и 6 л глицерина С3Н8О3. Плотность глицерина равна 1,26 г/мл; криоскопическая постоянная воды 1,86 (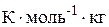 ).
).
Решение. Воспользуемся формулой
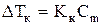 .
.
Подставим в формулу выражение для моляльной концентрации раствора,
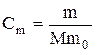 ,
,
получим расчетную формулу
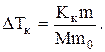
Согласно условиям задачи, масса глицерина
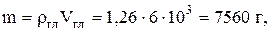
молярная масса глицерина 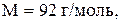
масса 20 л воды (в кг!)
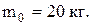
Выполняем подстановку:
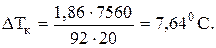
Рассчитываем температуру замерзания антифриза:
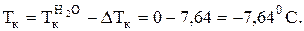
Эффект понижения температуры замерзания растворов электролитов используют при получении “холодных” бетонов. Так до -100С можно использовать для замешивания цемента водный раствор, содержащий 3% CaCl2 и 7% NaCl.
Пример 2. Рассчитайте массу хлорида натрия, которую необходимо добавить к одному литру воды для получения раствора, замерзающего при -70С. (a = 70%; 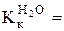 1,86 (
1,86 (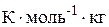 ).
).
Решение. Воспользуемся формулой:
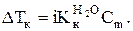
Выразим моляльную концентрацию раствора:
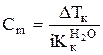 .
.
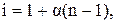 n = 2, так как при диссоциации хлорида натрия образуются два иона: NaCl = Na+ + Cl-.
n = 2, так как при диссоциации хлорида натрия образуются два иона: NaCl = Na+ + Cl-.
Значение изотонического коэффициента:
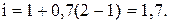
Рассчитываем моляльную концентрацию раствора:
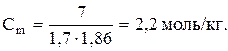
Это означает, что для получения такого раствора к 1 кг (1 л) воды следует добавить 2,2 моль хлорида натрия. Рассчитываем соответствующую массу хлорида натрия
 2015-06-14
2015-06-14 2152
2152